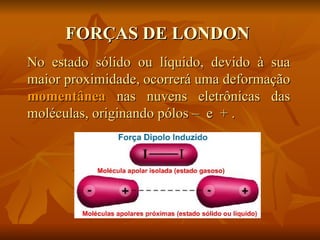
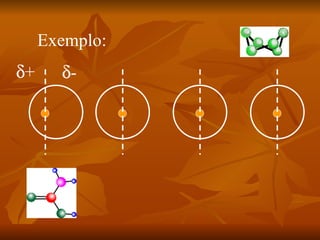
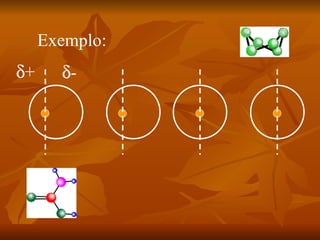
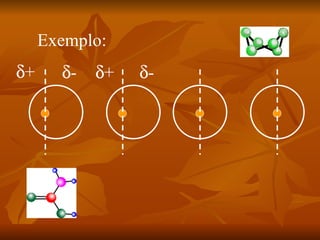
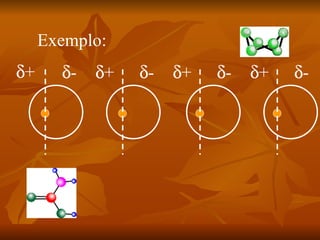
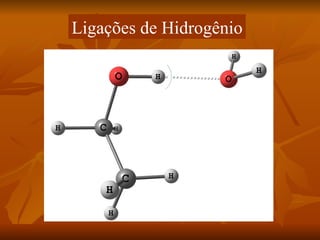
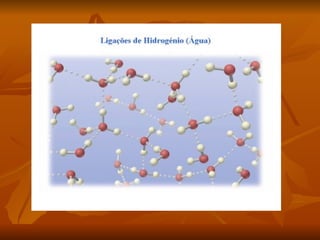
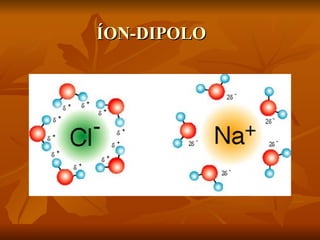
Este documento discute as forças intermoleculares que mantêm as moléculas unidas nos diferentes estados da matéria. Ele descreve as principais forças intermoleculares como forças de London, dipolo-dipolo, ligações de hidrogênio, íon-dipolo e como essas forças afetam propriedades como ponto de fusão e ebulição. Ele também discute exemplos dessas forças no cotidiano como a adesão de lagartixas em paredes.