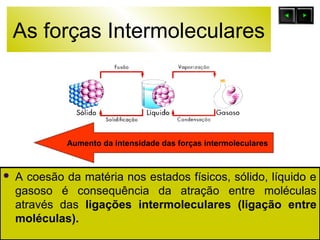
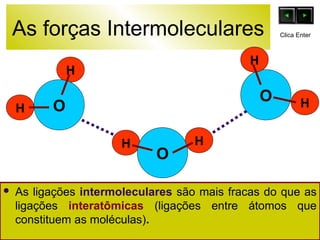
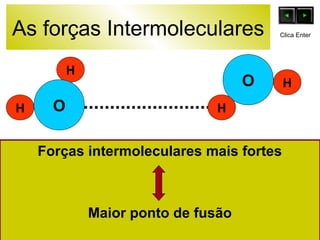
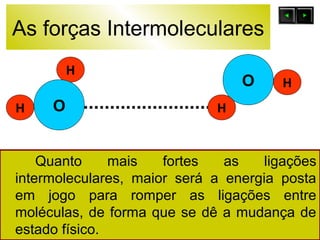
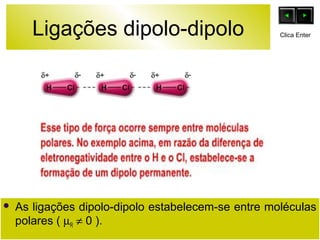
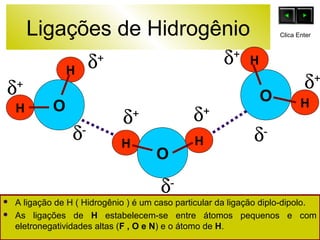
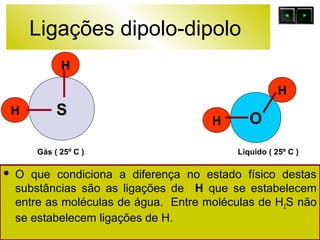
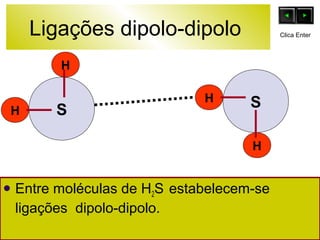
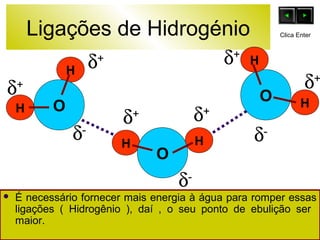
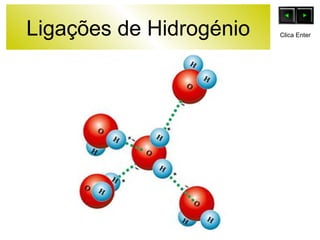
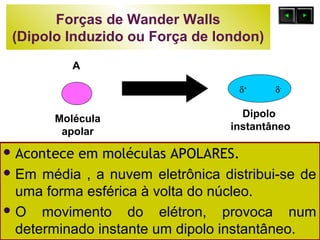
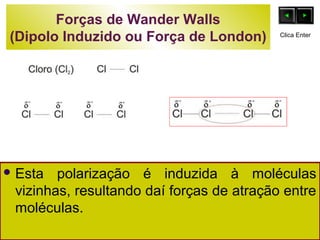
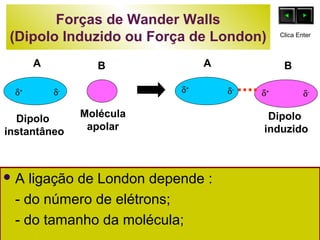
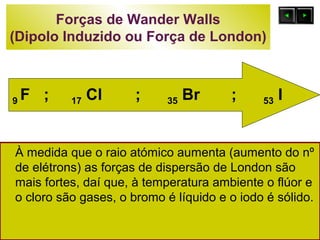
O documento discute as forças intermoleculares e como elas afetam os diferentes estados da matéria. Explica que quanto mais fracas as forças entre as moléculas, mais volátil a substância será. Detalha os tipos de ligações intermoleculares incluindo ligações de hidrogênio, dipolo-dipolo e London, e como cada uma contribui para a coesão dos diferentes estados físicos.