Incorporar apresentação
Transferir como PDF, PPTX



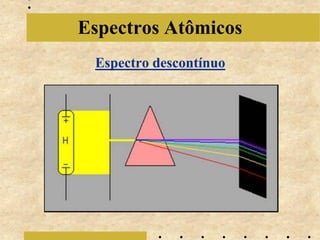


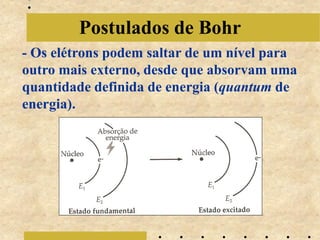

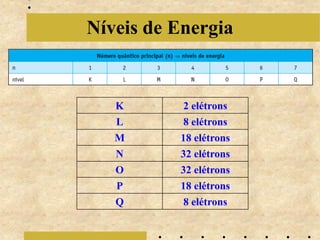





O documento descreve a evolução do modelo atômico de Bohr em 1913, começando com a teoria quântica de Planck em 1900 sobre a emissão de energia em "blocos" quantizados. Explica que cada elemento químico emite luz em espectros descontínuos únicos e detalha os postulados iniciais de Bohr sobre as órbitas eletrônicas. Também menciona contribuições posteriores de Sommerfeld, de Broglie, Heisenberg e Schrödinger que levaram ao modelo at












