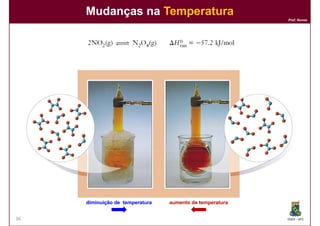
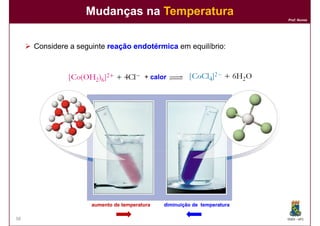
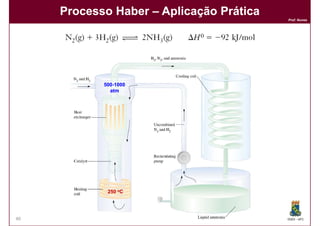
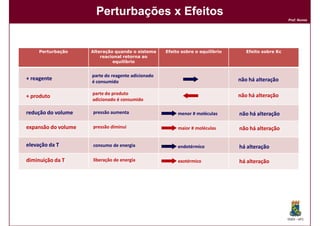
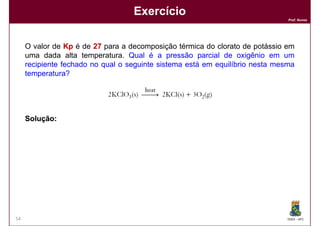
Este documento discute conceitos básicos de equilíbrio químico, incluindo:
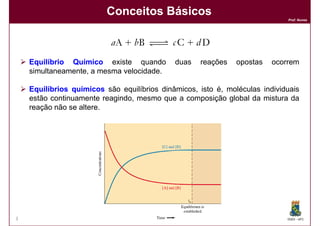
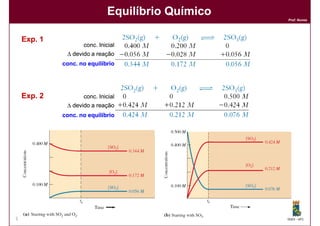
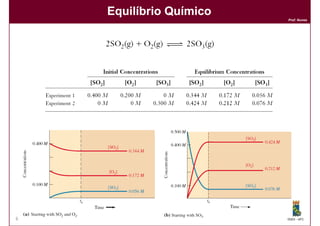
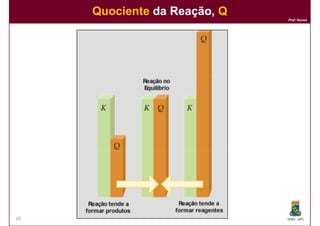
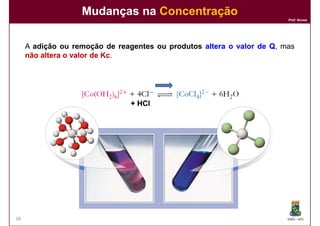
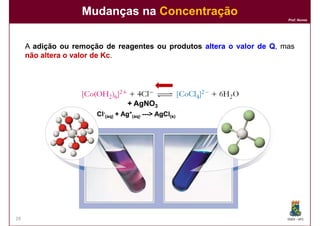
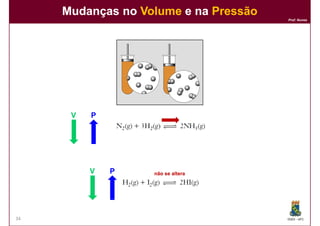
1) Reações químicas reversíveis podem atingir um estado de equilíbrio quando as velocidades das reações direta e inversa são iguais;
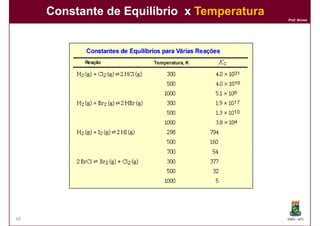
2) A constante de equilíbrio, Kc, é uma medida quantitativa do grau em que a reação ocorre no equilíbrio e depende apenas da temperatura.