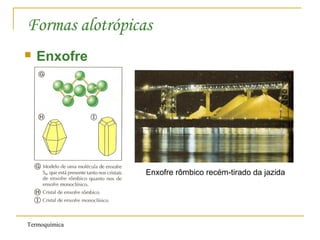
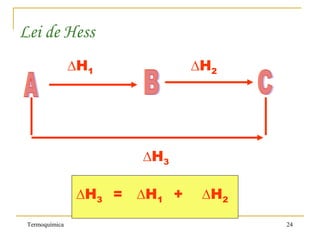
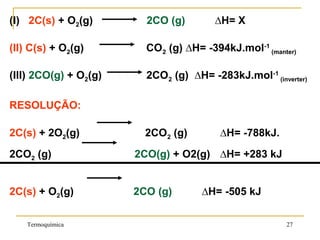
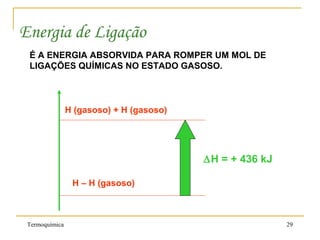
1. A Termoquímica estuda a quantidade de energia liberada ou absorvida por reações químicas sob a forma de calor.
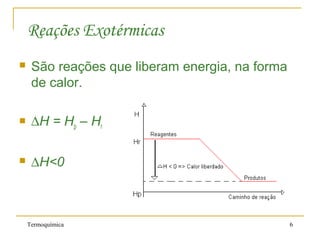
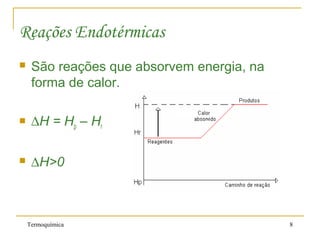
2. Reações químicas podem ser exotérmicas, liberando calor, ou endotérmicas, absorvendo calor.
3. A entalpia de uma substância é seu conteúdo energético e a variação de entalpia de uma reação (ΔH) é o calor liberado ou absorvido.