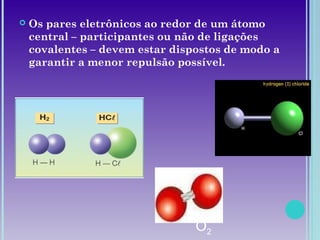
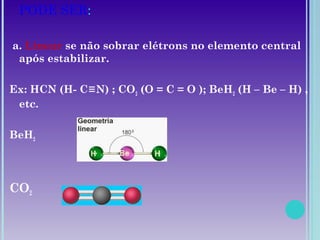
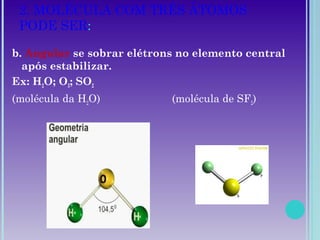
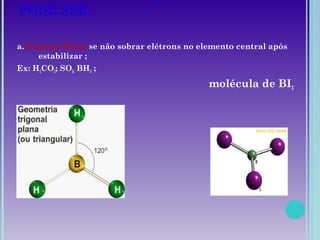
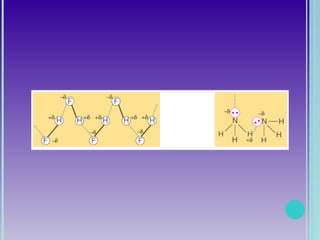
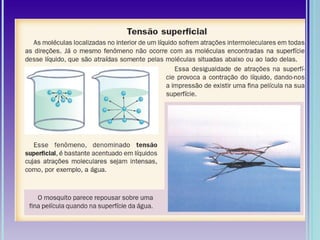
1. A geometria molecular descreve as formas geométricas que as moléculas assumem de acordo com a disposição dos átomos.
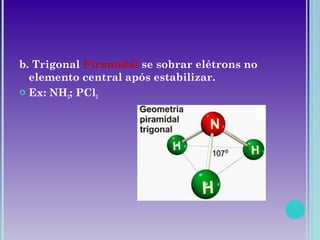
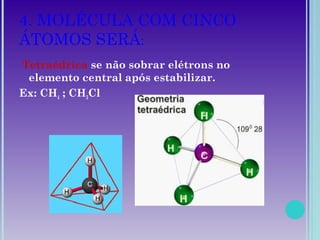
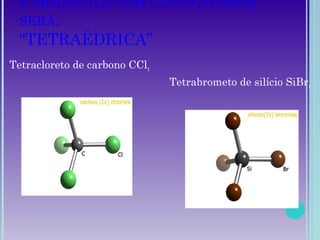
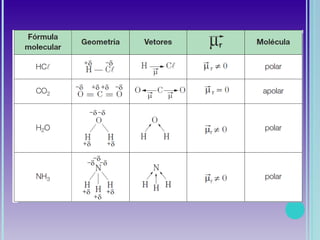
2. Moléculas diatômicas sempre apresentam geometria linear. Moléculas com mais átomos podem ter geometrias como linear, angular, trigonal plana, piramidal ou tetraédrica.
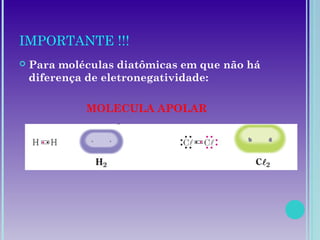
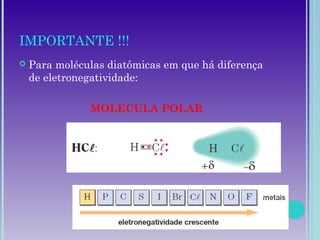
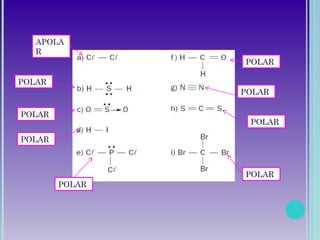
3. A polaridade depende da diferença de eletronegatividade entre os átomos e define a solubilidade da molécula.