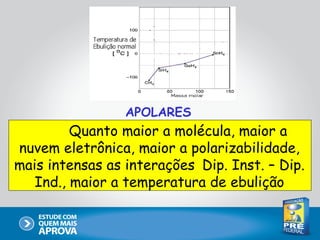
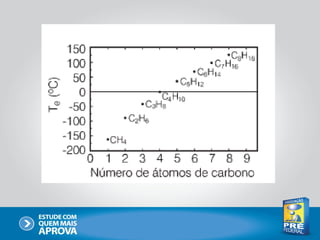
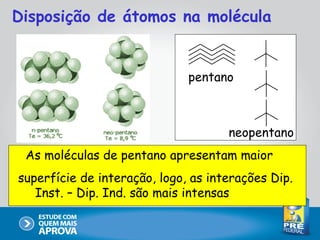
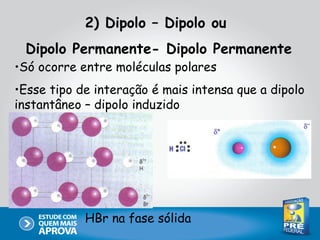
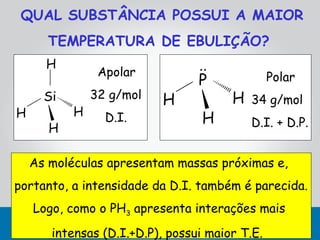
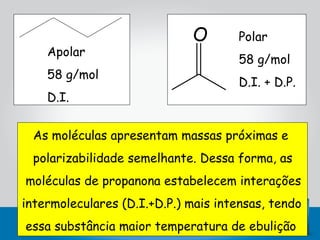
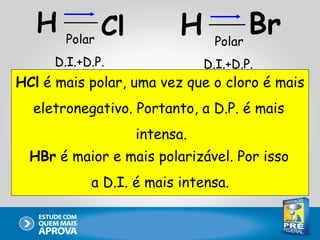
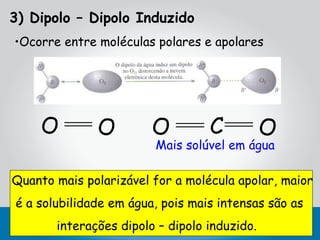
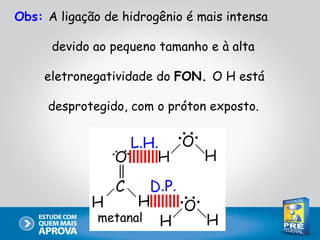
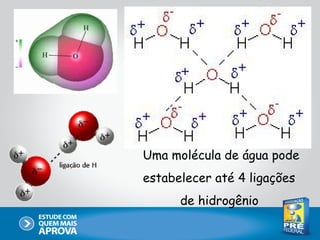
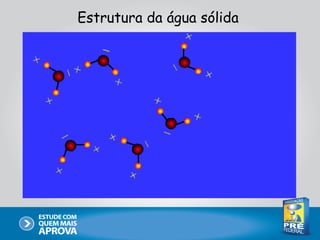
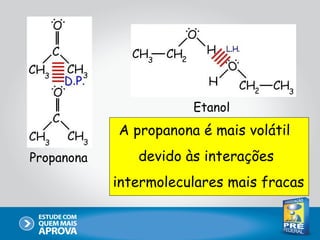
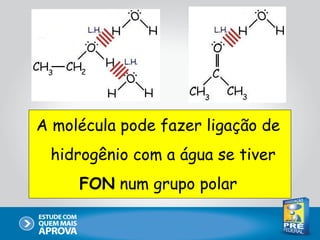
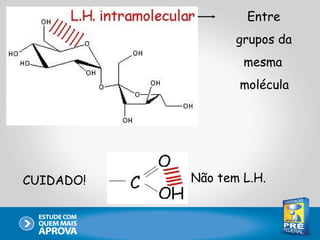
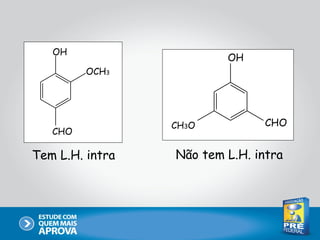
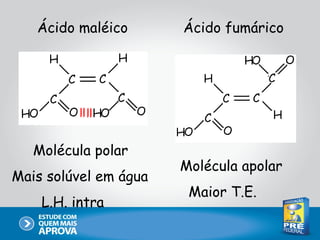
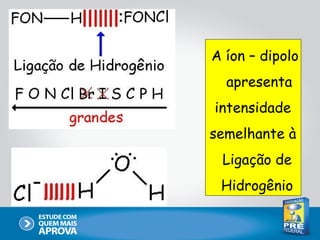
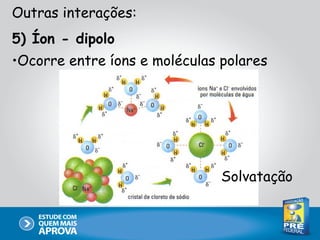
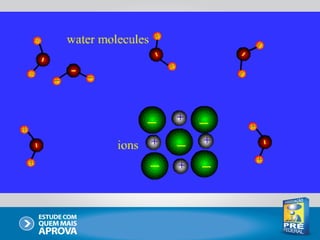
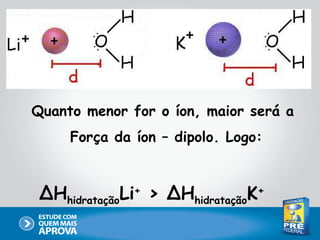
Este documento descreve as principais interações intermoleculares, que são forças fracas que ocorrem entre moléculas. São descritas seis interações: 1) dipolo instantâneo-dipolo induzido, 2) dipolo-dipolo, 3) dipolo-dipolo induzido, 4) ligação de hidrogênio, 5) íon-dipolo, 6) íon-dipolo induzido. Vários fatores como polarizabilidade, tamanho e disposição dos átomos afetam a intensidade dessas interações.