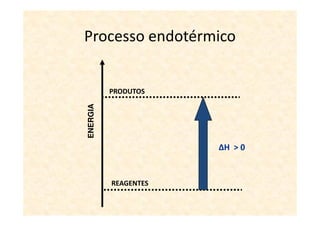
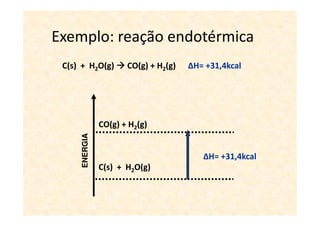
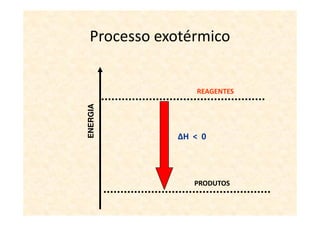
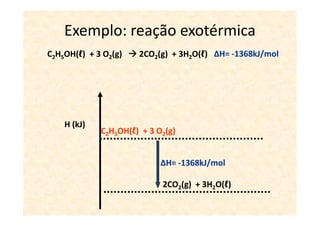
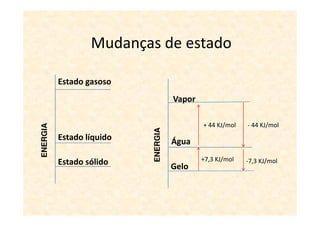
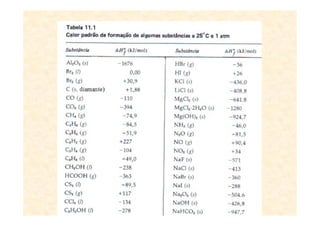
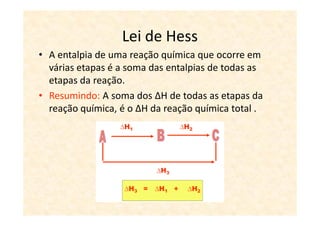
A termoquímica estuda processos químicos e físicos que envolvem absorção ou liberação de calor. Processos endotérmicos absorvem calor e processos exotérmicos liberam calor. A variação de entalpia (ΔH) de uma reação depende dos estados físicos iniciais e finais e é igual ao calor absorvido ou liberado.