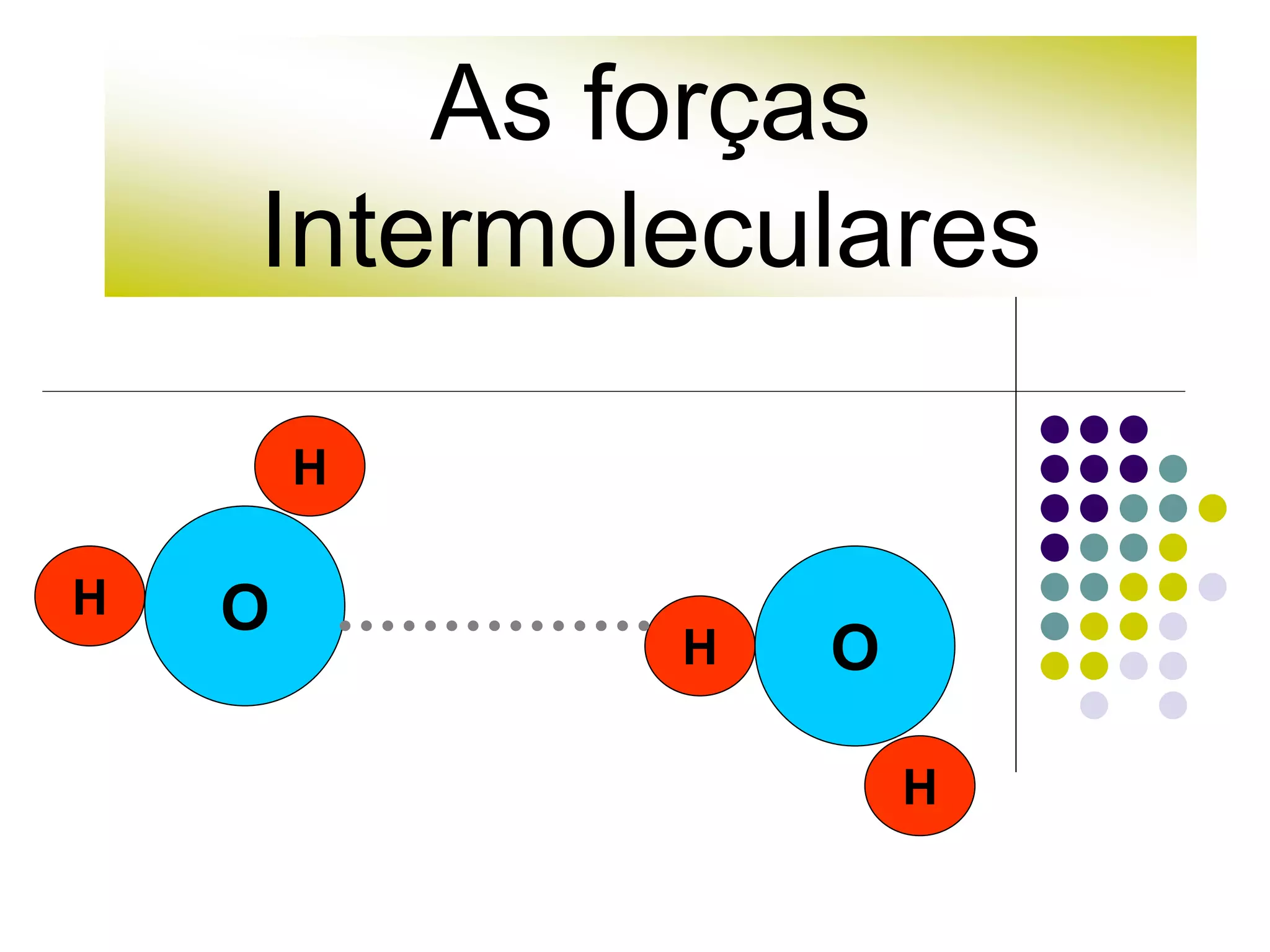
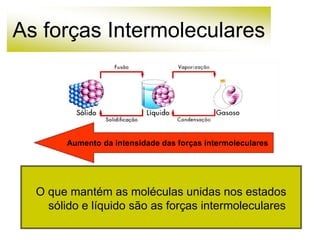
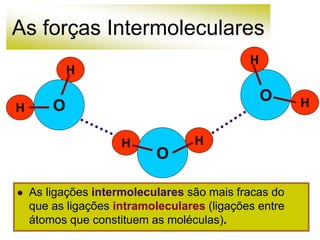
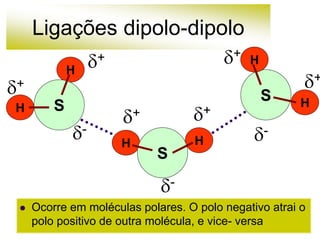
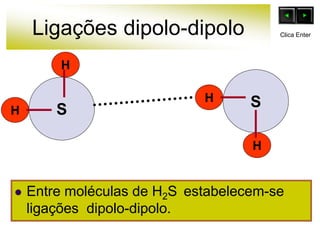
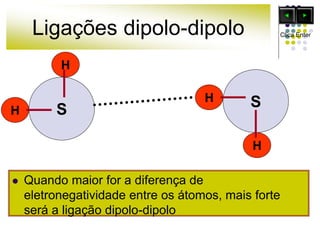
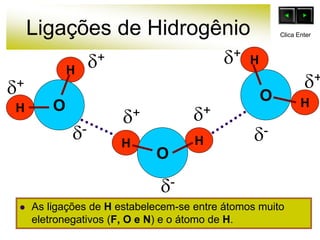
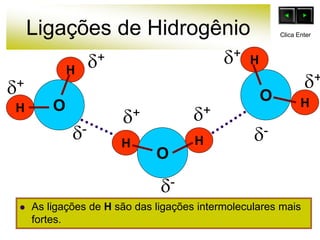
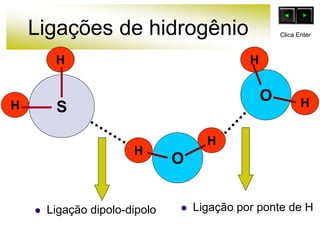
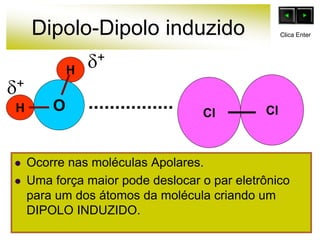
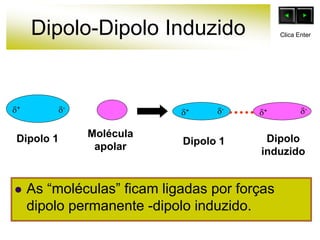
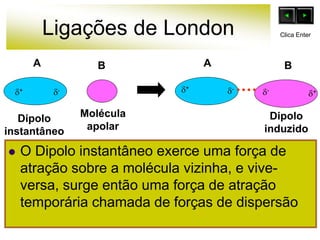
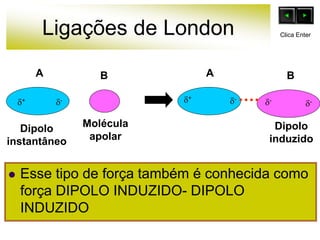
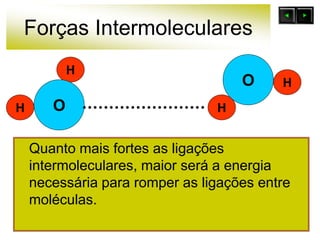
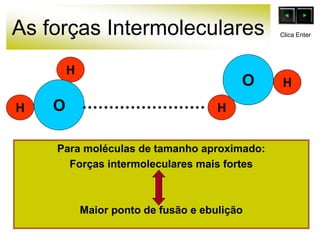
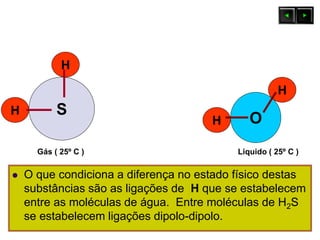
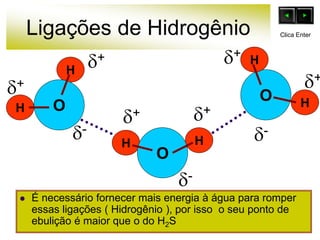
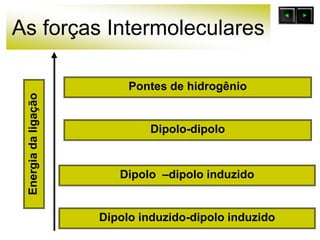
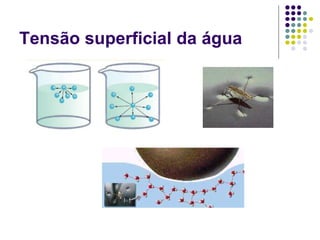
As forças intermoleculares mantêm as moléculas unidas nos estados sólido e líquido e incluem ligações de hidrogênio, dipolo-dipolo e London. Quanto mais fortes as ligações intermoleculares, maior a energia necessária para romper as ligações entre moléculas e maior o ponto de fusão e ebulição. As ligações de hidrogênio na água são particularmente fortes, explicando porque seu ponto de ebulição é mais alto do que outras substâncias com ligações mais fracas.