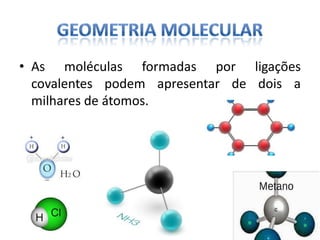
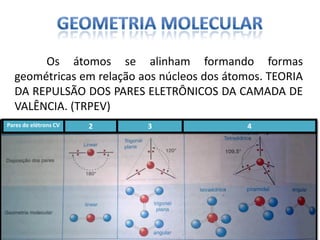
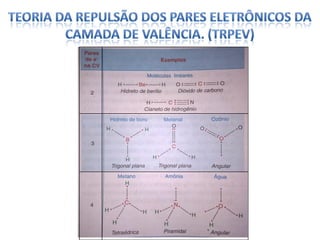
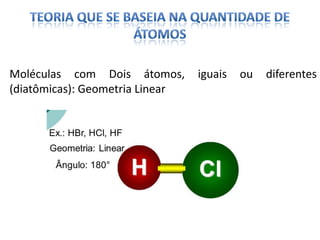
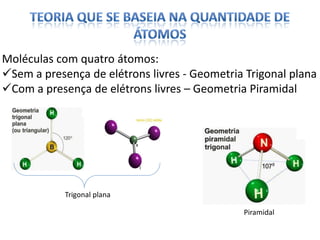
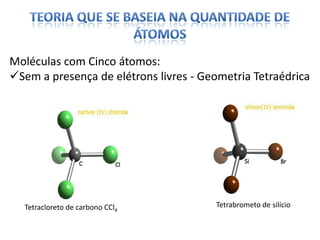
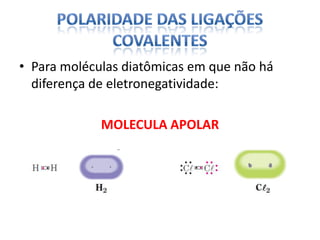
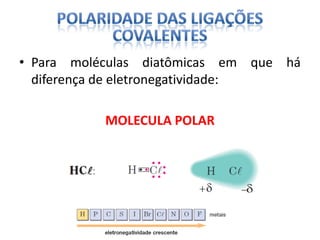
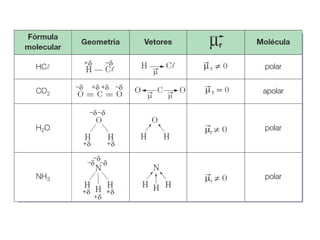
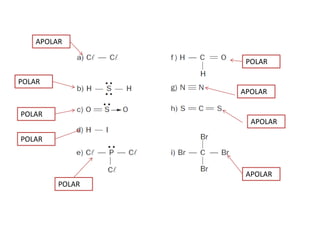
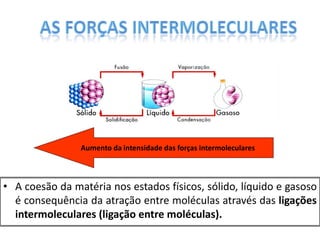
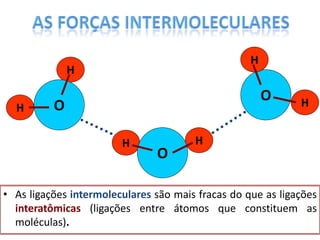
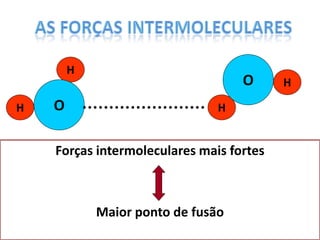
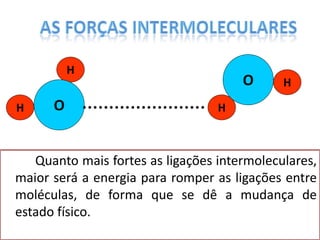
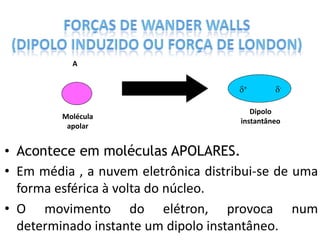
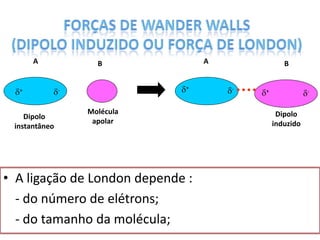
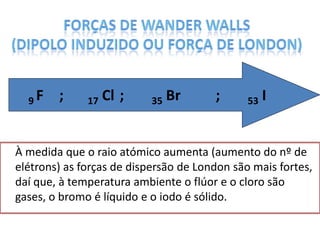
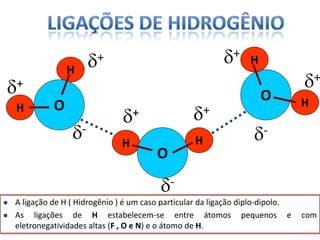
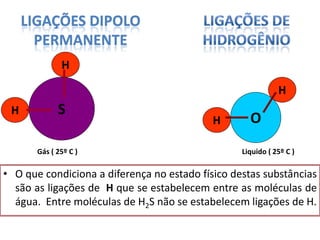
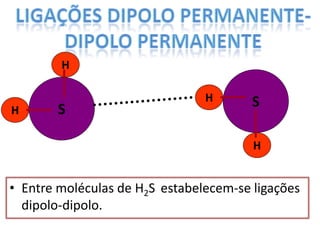
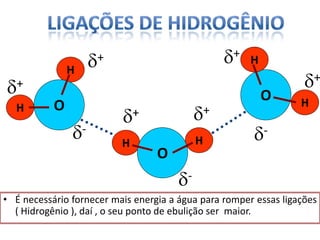
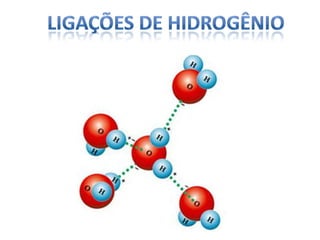
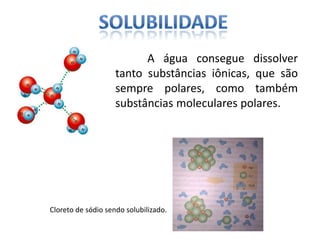
O documento discute as geometrias moleculares determinadas pela Teoria da Repulsão dos Pares Eletrônicos da Camada de Valência. É explicado que moléculas com dois átomos geralmente apresentam geometria linear, enquanto moléculas com três ou mais átomos podem ter geometrias lineares, angulares, trigonais planas ou piramidais, dependendo da presença ou ausência de elétrons livres. Além disso, discute-se a polaridade de ligações iônicas e covalentes.