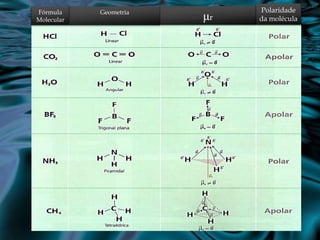
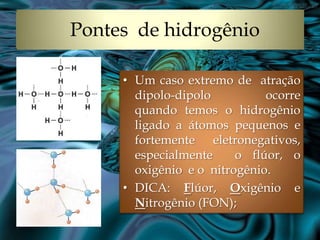
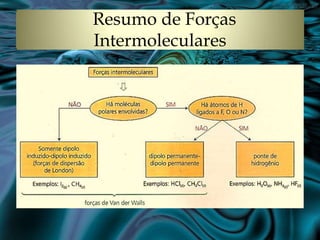
O documento discute conceitos sobre polaridade molecular, forças intermoleculares e solubilidade. Explica que a polaridade depende da eletronegatividade dos átomos e geometria molecular, e que substâncias polares se dissolvem em substâncias polares, enquanto substâncias apolares se dissolvem em outras apolares. Detalha três tipos de forças intermoleculares: forças de van der Waals, interações dipolo-dipolo e pontes de hidrogênio, sendo esta última responsável pelas propriedades únicas da á