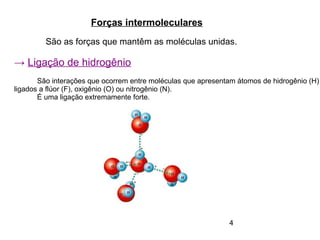
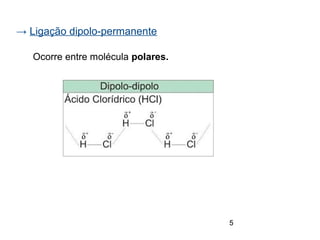
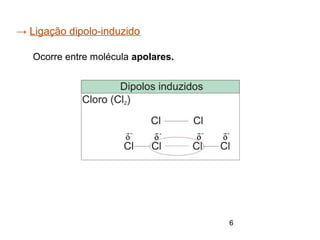
O documento discute eletronegatividade e polaridade de ligações. Explica que ligações entre átomos com diferentes eletronegatividade são polares, enquanto ligações entre átomos iguais são apolares. Também discute como a polaridade afeta a solubilidade e as forças intermoleculares entre substâncias.