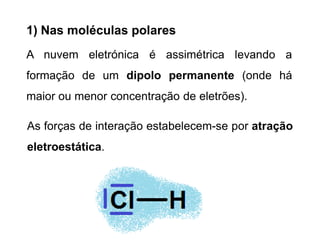
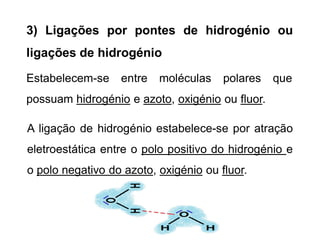
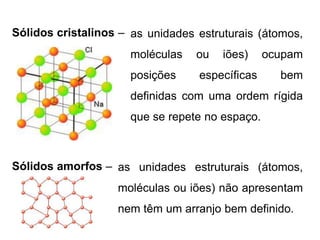
O documento discute as forças intermoleculares de Van der Waals que ocorrem entre moléculas. Estas forças podem ser divididas em forças de atração entre moléculas polares devido a dipolos permanentes e induzidos, e forças de dispersão entre moléculas apolares. Ligação de hidrogênio também é discutida como uma força intermolecular entre moléculas contendo hidrogênio, nitrogênio ou oxigênio.