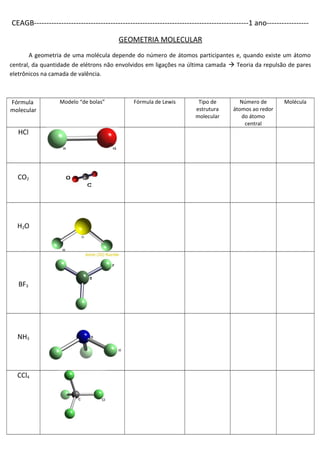
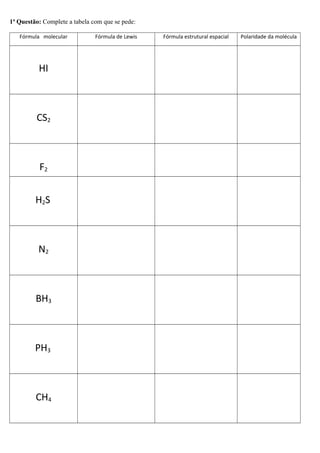
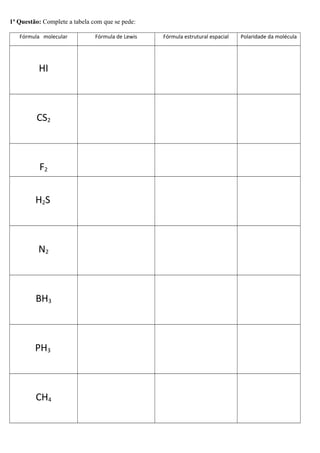
O documento discute os tipos de ligação química - iônica, covalente e metálica. Explica as propriedades de compostos iônicos e moleculares, e como determinar a fórmula de compostos iônicos. Também aborda a geometria molecular de acordo com a teoria da repulsão de pares eletrônicos.
![LIGAÇÃO QUIMICA
* A capacidade que um átomo tem, de atrair elétrons de
outro átomo quando os dois formam uma ligação
química, é denominada Eletronegatividade .
1) LIGAÇÃO IONICA
É a ligação que ocorre entre átomos que apresentam grande
tendência em perder elétrons (metais) e átomos que
apresentam grande tendência em receber elétrons (ametais e
hidrogênio). Logo, esta ligação é conseqüência da atração
eletrostática entre íons , com cargas opostas, formados pela
transferência de elétrons.
Ex.: NaCl (cloreto de sódio, sal de cozinha)
Na => possui 11 prótons, logo 11 elétrons
Cl => possui 17 prótons, logo 17 elétrons
(ver abaixo distribuição dos elétrons nas camadas)
Propriedades dos compostos iônicos
-São sólidos nas condições ambientes (T = 25 ºC, P = 1atm)
devido a força de atração eletrostática entre cátions e ânions
ser muito intensa.
-São sólidos duros e quebradiços.
-Apresentam altos pontos de fusão, devido também as forças
de atração que são intensas.
Exemplos:
NaCl → ponto de fusão = 800 ºC
CaF2 → ponto de fusão = 1600 ºC
-Quando em solução aquosa (dissolvidos em água) ou
fundidos (líquidos), conduzem a corrente elétrica.
- Regra prática para determinação da fórmula dos
compostos iônicos.
FÓRMULA DO ÍON
Por recomendação da Sociedade Brasileira de Química (SBQ),
na fórmula de um íon, a carga deve ser indicada assim: Al3+
(e
não Al+3
), O2-
(e não O -2
), e assim por diante.
Para montar a fórmula da substância formada, seguimos estas
regras:
• O cátion sempre será escrito à esquerda e o ânion à direita.
• Toda fórmula é eletricamente neutra, ou seja, a soma das
cargas positivas sempre será igual à soma das cargas
negativas.
Portanto, a fórmula da substância formada pelos íons Al3+
e
O2-
será:
[Al 3+
]2[O 2-
]3
Observe que essa proporção de números de íons apresenta
igual número de cargas positivas e negativas:
2 Al 3+
6 cargas positivas (+ 6)
3 O 2-
6 cargas negativas (-6)
Em outras palavras, [Al3+
]2[O2-
]3 é uma fórmula
eletricamente neutra.
Resumidamente, a fórmula de uma substância iônica segue o
esquema:
[Cx+
][Ay-
] [Cx+
]y[Ay-
]x (ou apenas CyAx)
Voltando ao exemplo anterior:
[Al 3+
][ O 2-
] [Al 3+
]2[O 2-
]3 (ou apenas Al2O3)
2) LIGAÇÃO COVALENTE OU LIGAÇÃO MOLECULAR
- LIGAÇÃO COVALENTE NORMAL
É a ligação que ocorre entre átomos que possuem a
tendência de ganhar elétrons para atingir a estabilidade. Esta
ligação acontece através do compartilhamento de elétrons
dos átomos ligados.
A ligação covalente ocorre entre dois átomos ametais, ou
ainda, entre ametal e o hidrogênio.
Ex1: Molécula de Hidrogênio (H2)
Fórmula Fórmula eletrônica Fórmula estrututal
molecular ou de Lewis plana](https://image.slidesharecdn.com/ligacaoquimica-190210204632/75/Ligacao-quimica-1-2048.jpg)

![Liga metálica: são materiais com propriedades metálicas que
contêm dois ou mais elementos, sendo pelo menos um deles
metal.
Exs: ouro 18 quilates: é uma liga de 18 partes de ouro e 6 partes de
outros metais, representando assim, 75% de ouro e 25% de prata,
cobre ou bronze.
Amálgama: liga de Hg, Ag e Sn
Bronze: liga de Cu e Sn
Latão: liga de Cu e Zn
Aço Inox: liga de Fe, C , Cr e Ni.
Fonte: http://pt.scribd.com/doc/3624867/Quimica-
PreVestibular-Impacto-Ligacao-Formulacao
O que mantém as moléculas unidas nos estados líquido
e sólido? Que força faz a água, contrariando a
gravidade, subir desde a raiz até o topo da árvore mais
alta? Como alguns insetos podem andar sobre a água?
Por que o DNA tem a configuração em forma de
hélice? Elas estão por toda a parte: as Forças
Intermoleculares.
Todos os objetos ao nosso redor são feitos de átomos.
Estes átomos, algumas vezes, combinam-se e
formam moléculas: são unidos através da formação de
ligações covalentes. [...] Mas as moléculas são discretas:
a água, por exemplo, consiste em pequenos grupos de 3
átomos, sendo um do elemento oxigênio que liga-se a
dois átomos de hidrogênio. A ligação covalente,
entretanto, é intramolecular: apenas une os átomos que
formam a molécula. O que impede, entretanto, que todas
as moléculas em um copo de água se difundam pelo
meio, instantaneamente, deixando o copo vazio? O que
mantém elas unidas? Como elas formam um objeto
sólido, compacto, quando resfriadas?
As forças que existem entre as moléculas - forças
intermoleculares - não são tão fortes como as ligações
iônicas ou covalentes, mas são muito importantes;
sobretudo quando se deseja explicar as propriedades
macroscópicas da substância. E são estas forças as
responsáveis pela existência de 3 estados físicos. Sem
elas, só existiriam gases.
As forças intermoleculares têm origem eletrônica:
surgem de uma atração eletrostática entre nuvens de
elétrons e núcleos atômicos. São fracas, se comparadas às
ligações covalentes ou iônicas. Mas forte o suficiente](https://image.slidesharecdn.com/ligacaoquimica-190210204632/85/Ligacao-quimica-3-320.jpg)