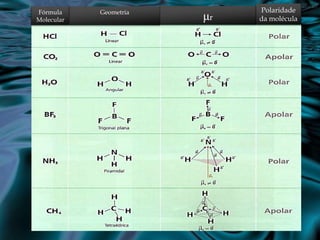
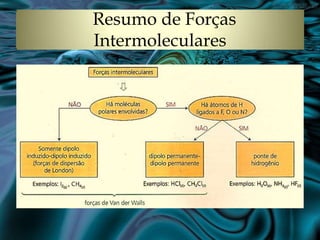
O documento discute conceitos de polaridade molecular, ligações polares e apolares, e as forças intermoleculares que regem a solubilidade e as propriedades físicas de substâncias. Explica que moléculas polares se dissolvem em outras polares, e apolares em outras apolares, devido às forças dipolo-dipolo, de dispersão de London, e pontes de hidrogênio entre moléculas.