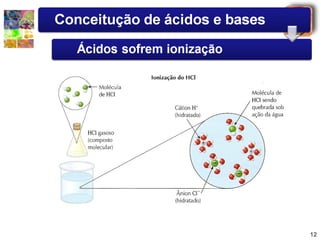
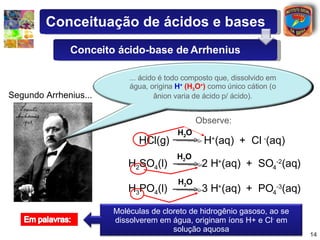
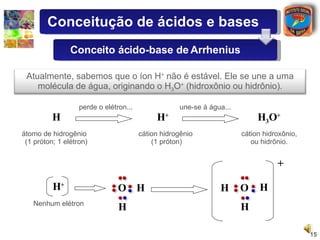
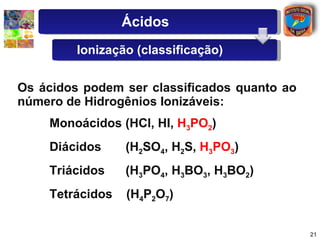
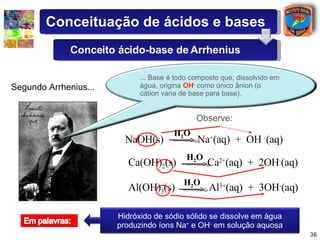
1) O documento introduz conceitos sobre ácidos e bases, incluindo as definições de Arrhenius e a classificação de ácidos de acordo com o número de hidrogênios ionizáveis.
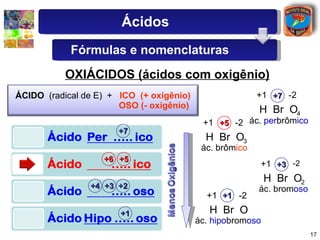
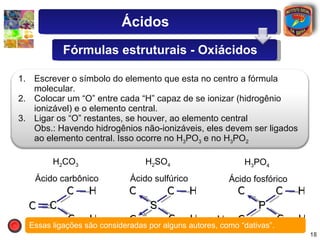
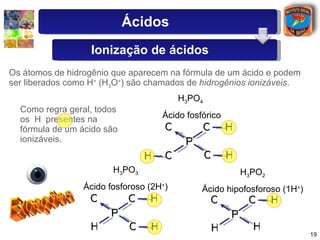
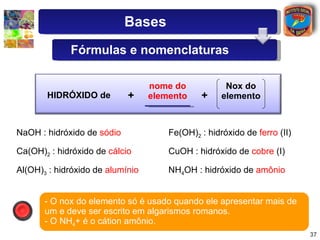
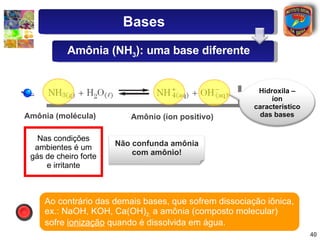
2) São descritas as principais diferenças entre ácidos hidrácidos e oxiácidos, assim como suas nomenclaturas e fórmulas estruturais.
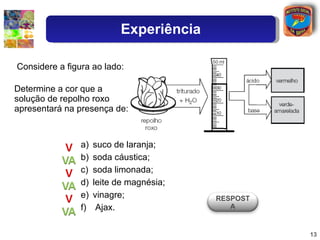
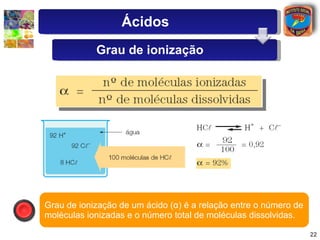
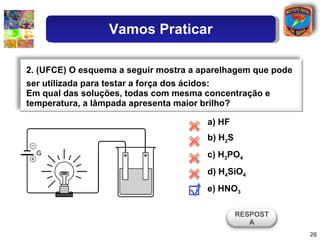
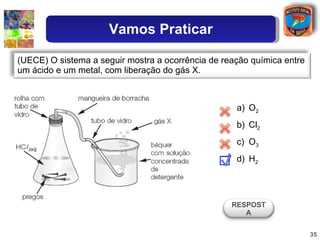
3) Exemplos ilustram como o grau de ionização determina a força relativa de diferentes ácidos.






























![Produzido por: Prof. Nelson Virgilio Engenheiro Químico – UFBA [email_address] Blog: http://ensinodigital.blogspot.com Créditos](https://image.slidesharecdn.com/21-cidos-e-bases-1212197278418041-9/85/Aula-Digital-de-Quimica-Acidos-e-Bases-53-320.jpg)