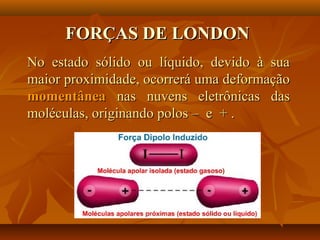
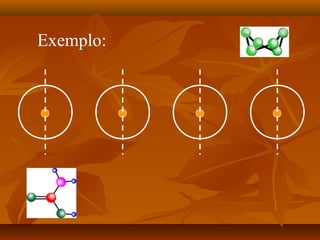
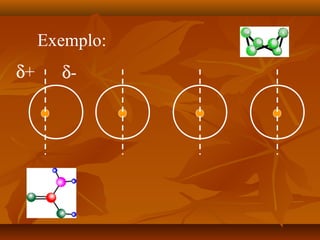
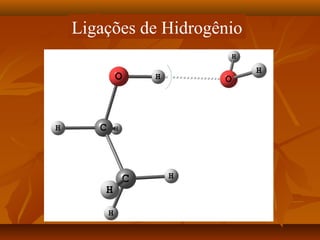
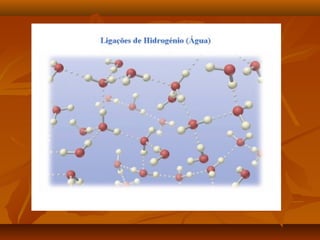
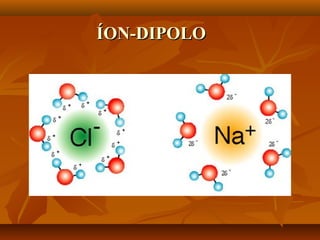
O documento discute as forças intermoleculares, incluindo forças de London, dipolo-dipolo, ligações de hidrogênio e íon-dipolo. Essas forças mantêm as moléculas juntas nos três estados da matéria e explicam propriedades como ponto de fusão, ebulição e tensão superficial.