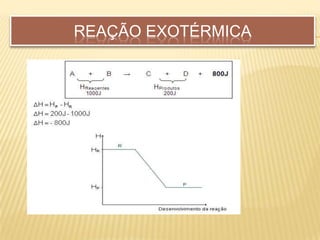
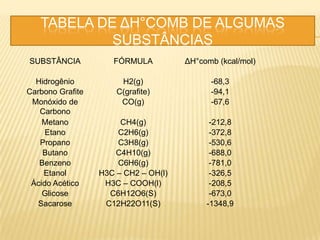
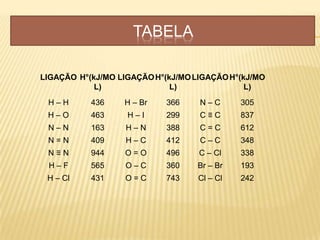
O documento discute os conceitos fundamentais da termoquímica, incluindo: 1) A termoquímica estuda as quantidades de calor envolvidas em reações químicas; 2) As reações podem ser endotérmicas ou exotérmicas dependendo se absorvem ou liberam calor; 3) A variação de entalpia (ΔH) mede a quantidade neta de calor envolvida em uma reação química.