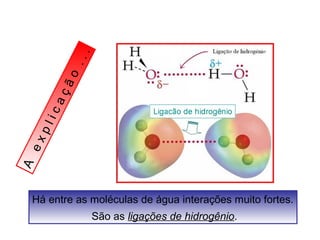
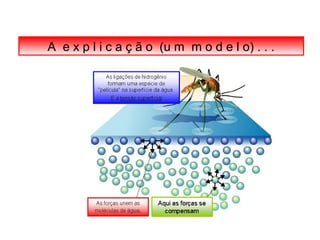
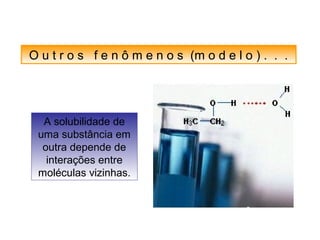
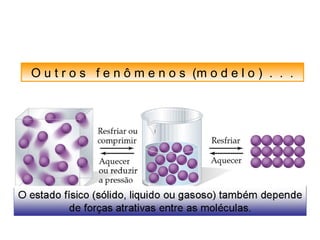
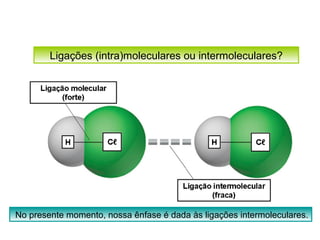
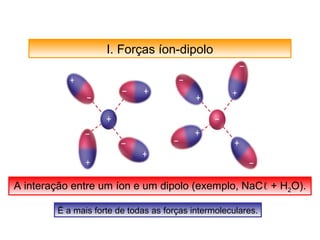
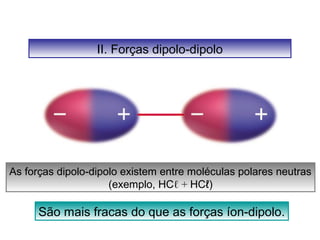
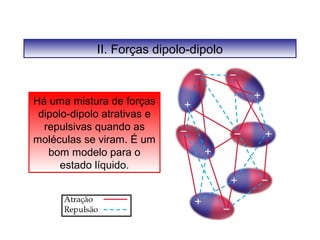
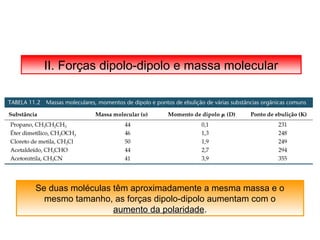
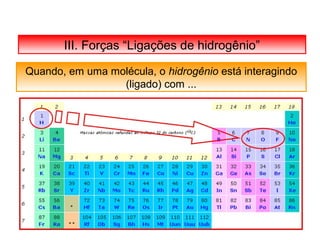
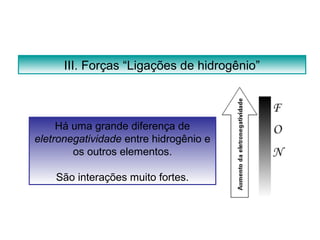
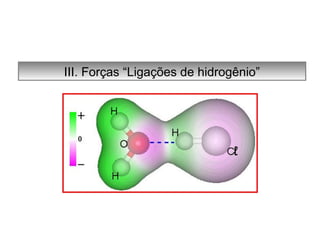
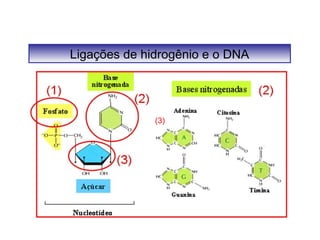
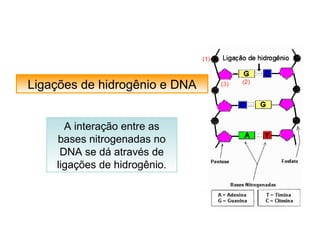
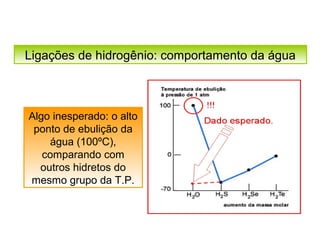
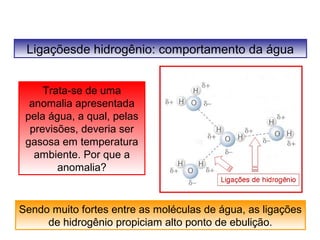
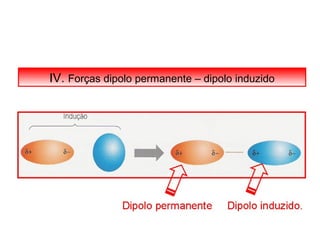
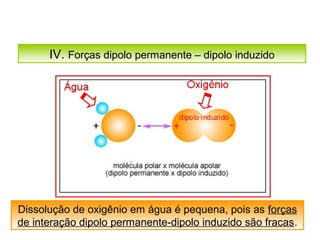
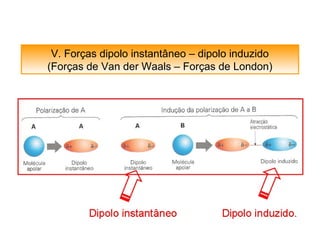
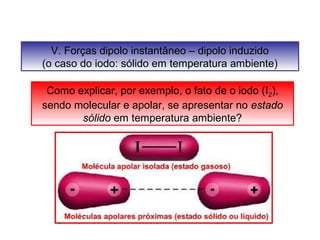
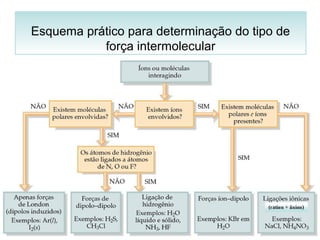
O documento discute as diferentes forças intermoleculares que permitem que lagartixas andem em paredes e insetos não afundem na água. Explica que as forças de Van der Waals, como as forças de dispersão de London, permitem que moléculas se atraiam, enquanto as ligações de hidrogênio entre moléculas de água conferem propriedades incomuns à água.