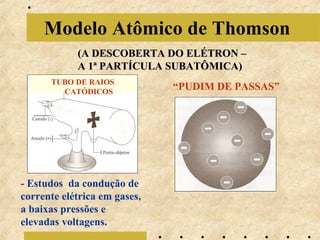
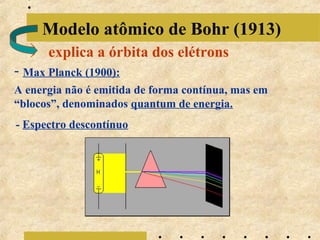
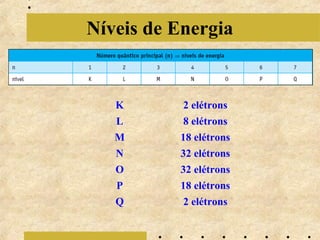
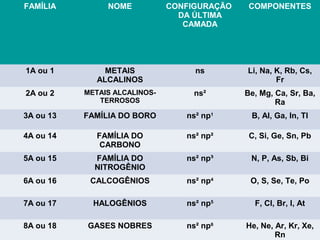
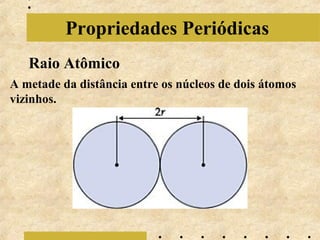
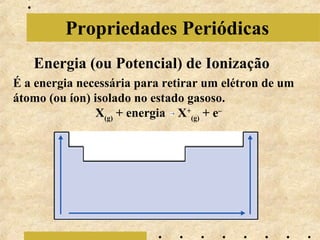
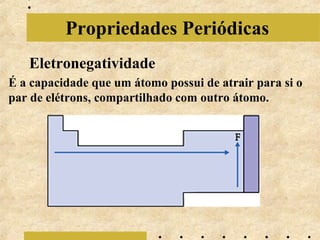
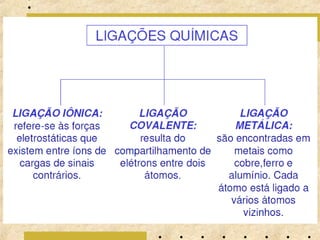
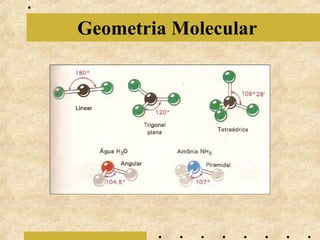
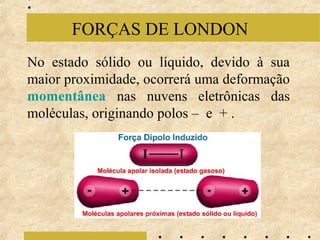
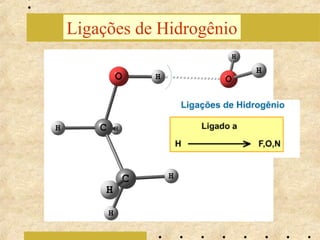
O documento apresenta os principais modelos atômicos históricos, como o de Dalton, Thomson, Rutherford e Bohr. Também aborda a tabela periódica, incluindo suas características, famílias e propriedades periódicas dos elementos. Por fim, discute conceitos de geometria molecular e forças intermoleculares.