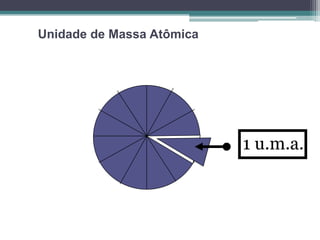
[1] O documento discute conceitos fundamentais de massa atômica, massa molecular e quantidade de matéria, incluindo as unidades de medida associadas como unidade de massa atômica (uma) e mol. [2] É introduzido o conceito de que 1 mol equivale a 6,02 x 1023 unidades elementares como átomos ou moléculas e é usado para quantificar quantidades de substâncias. [3] O mol é útil para determinar números de unidades elementares em uma amonta de matéria, converter entre massa e número de entidades, e facilit