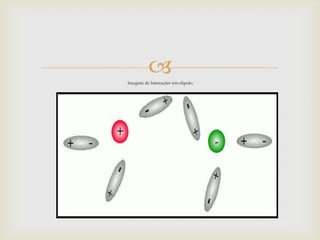
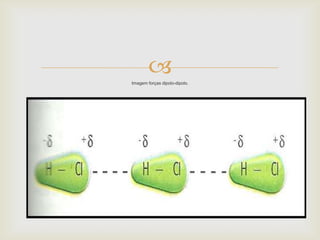
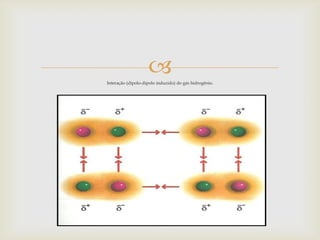
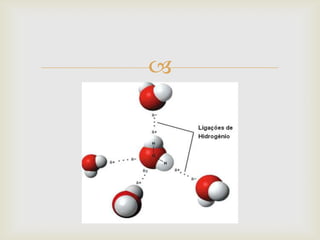
Este documento descreve as principais forças intermoleculares, incluindo forças iôn-dipolo, dipolo-dipolo, de London e de hidrogênio. Explica que quando moléculas se aproximam, interagem através de seus campos magnéticos, gerando forças entre elas. Essas forças dependem da polaridade das moléculas e da proximidade entre elas.