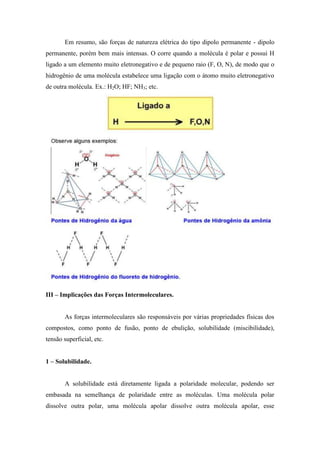
1) As forças intermoleculares determinam as propriedades físicas dos materiais e são responsáveis pelas diferenças entre os estados físicos sólido, líquido e gasoso.
2) Existem diferentes tipos de forças intermoleculares, incluindo forças de van der Waals, ligação de hidrogênio e interações iônico-dipolo.
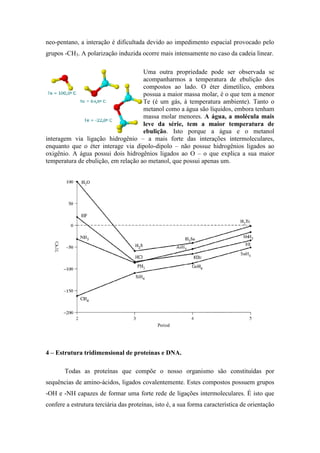
3) As forças intermoleculares afetam propriedades como ponto de fusão, ponto de ebulição, solubilidade e tensão superficial. Quantas mais fortes forem as for