Incorporar apresentação
Baixado 171 vezes



![Ligações de hidrogênio
(pontes de hidrogênio)
• Elementos muito pequenos
e muito eletronegativos
quando ligados ao
hidrogênio provocam
grande polarização da
molécula
H + [F, O, N]](https://image.slidesharecdn.com/tiposdeinteraesmoleculares-141116184633-conversion-gate01/85/Tipos-de-interacoes-moleculares-8-320.jpg)
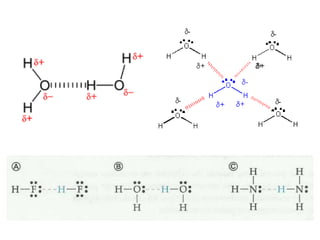
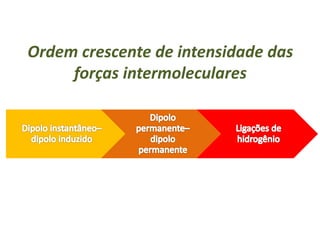

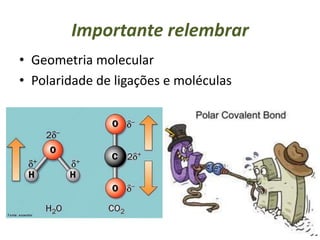
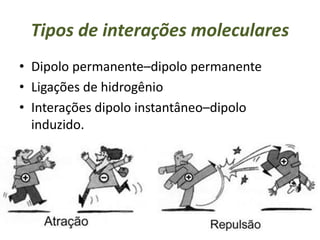
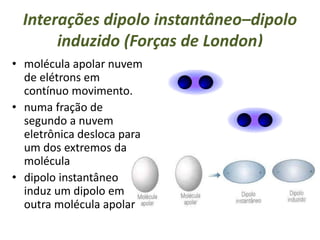
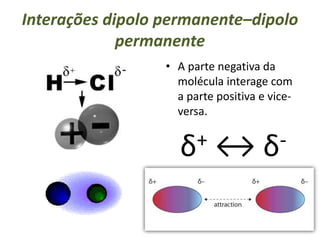
O documento discute os tipos de interações moleculares, incluindo forças de Van der Waals, ligações de hidrogênio e interações dipolo-dipolo. Essas forças mantêm as moléculas unidas nos estados sólido e líquido e ocorrem em moléculas polares e apolares. As interações são classificadas por ordem crescente de intensidade.







![Ligações de hidrogênio
(pontes de hidrogênio)
• Elementos muito pequenos
e muito eletronegativos
quando ligados ao
hidrogênio provocam
grande polarização da
molécula
H + [F, O, N]](https://image.slidesharecdn.com/tiposdeinteraesmoleculares-141116184633-conversion-gate01/85/Tipos-de-interacoes-moleculares-8-320.jpg)

