Este documento discute ligações intermoleculares, incluindo:
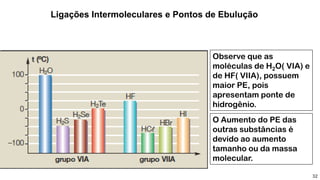
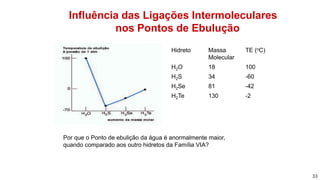
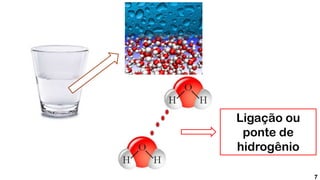
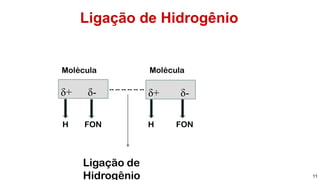
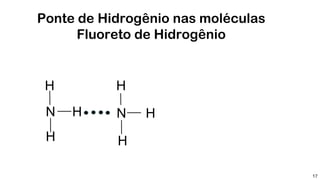
1) Ligações de hidrogênio são responsáveis pela atração entre moléculas de água;
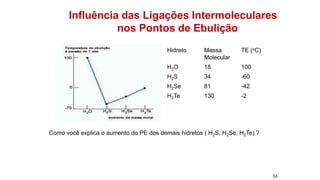
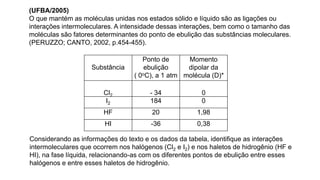
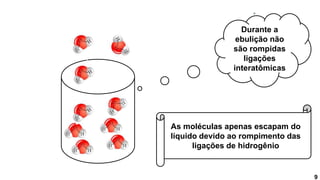
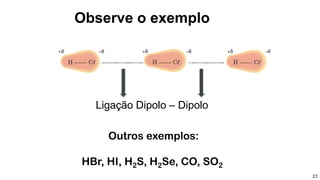
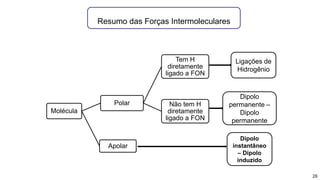
2) Diferentes tipos de ligações intermoleculares afetam pontos de ebulição e propriedades de substâncias;
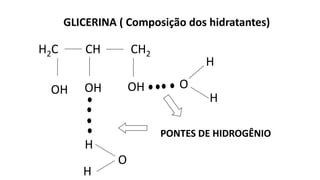
3) Propriedades da pele humana são influenciadas por ligações de hidrogênio em hidratantes.





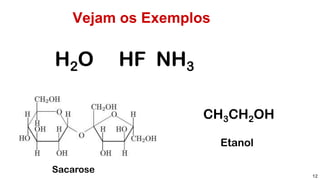










![Reposta:[D]
NaCl em água. Os íons provenientes da dissociação do sal
interagem com dipolos permanentes presentes em
moléculas de água. Portanto, temos a interação íon-dipolo.
Acetona em água. A acetona é uma molécula polar, que
interage com moléculas de água por meio de forças dipolo-
dipolo.
Etanol em água. Devido à presença do grupo hidroxila,
tanto na água quanto no etanol. Observa-se o predomínio
de ligações de hidrogênio intermoleculares.](https://image.slidesharecdn.com/ligaointermolecular-130918143659-phpapp02/85/Ligaa-a-o-intermolecular-28-320.jpg)