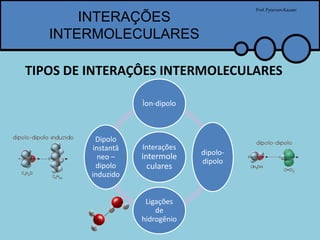
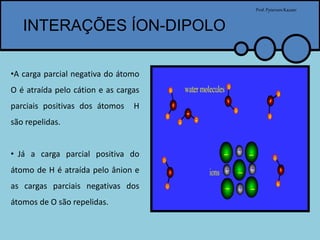
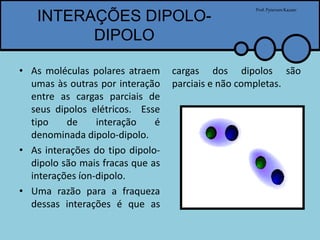
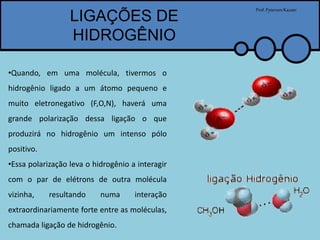
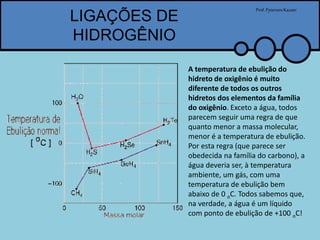
O documento apresenta um professor, Pyterson Kazaer, discutindo diferentes tipos de interações intermoleculares, incluindo ligações de hidrogênio, interações iôn-dipolo, dipolo-dipolo e forças de van der Waals. Exemplos como a hidratação de íons e as propriedades incomuns da água são usados para ilustrar essas interações.