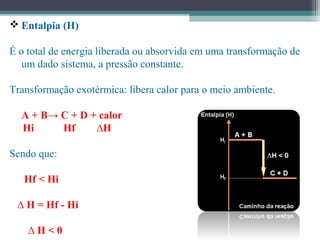
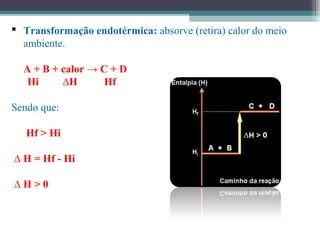
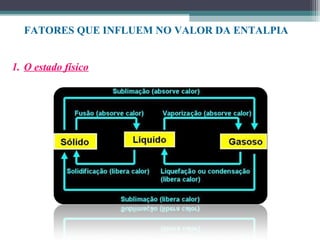
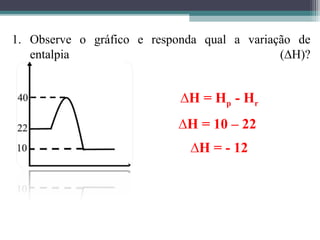
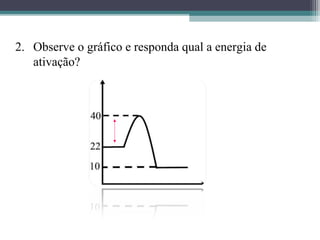
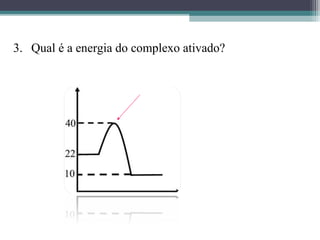
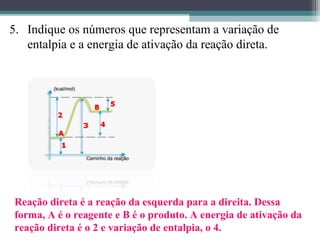
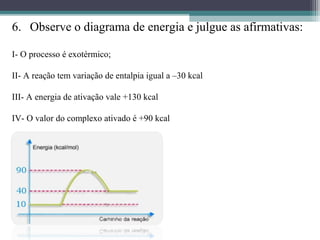
O documento discute termos relacionados à termoquímica, incluindo: 1) Transformações termoquímicas podem ser exotérmicas ou endotérmicas; 2) Entalpia (H) é a energia liberada ou absorvida em uma transformação química; 3) Vários fatores influenciam o valor da entalpia, como estado físico e alotrópico dos reagentes.