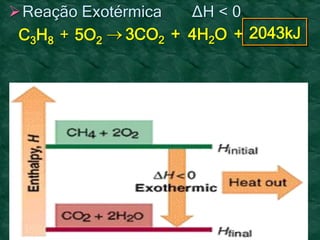
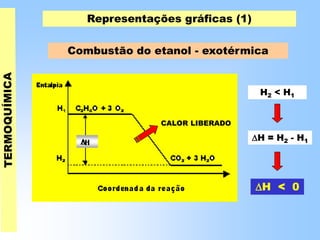
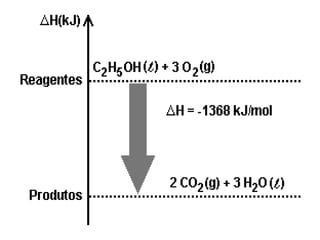
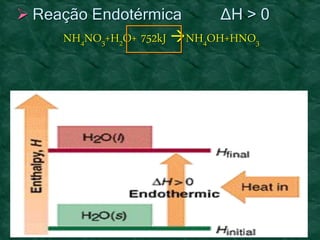
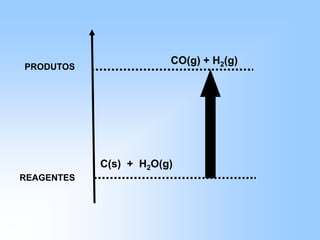
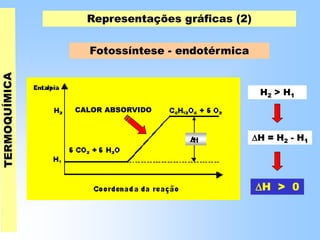
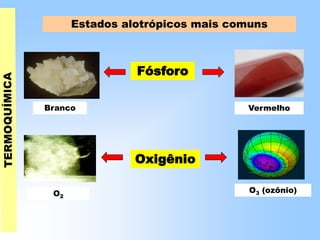
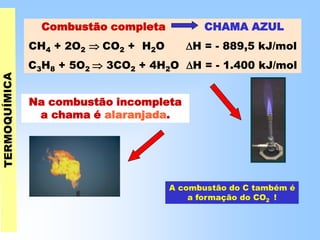
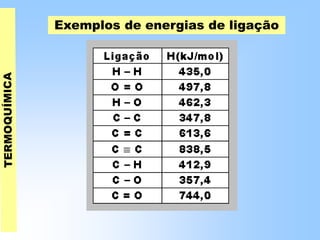
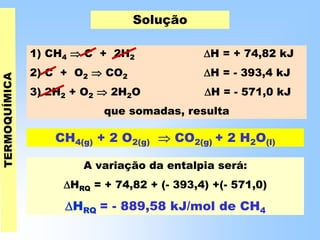
O documento discute os conceitos fundamentais da termoquímica, incluindo: (1) o estudo do calor envolvido em reações químicas, (2) as variações de energia que acompanham reações, (3) reações exotérmicas e endotérmicas, e (4) diferentes tipos de entalpias como formação, decomposição e combustão.