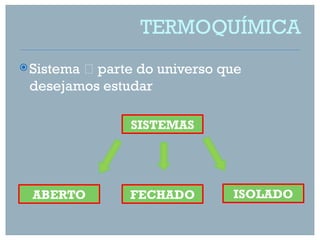
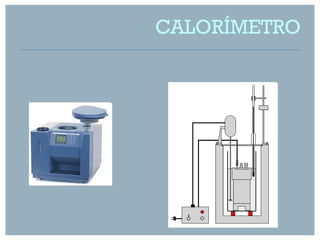
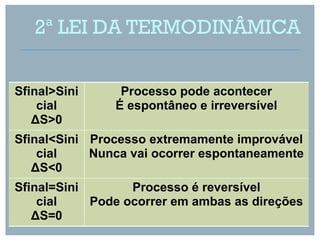
De acordo com a lei de Hess, podemos calcular a entalpia de formação de AlCl3 a partir da soma das entalpias das reações elementares.
2Al(s) + 6HCl(aq) → 2AlCl3(aq) + 3H2(g) ΔH = -1049 kJ
3HCl(g) → 3HCl(aq) ΔH = -3 × 78.4 = -235.2 kJ
3H2(g) + 3Cl2(g) → 6HCl(g) ΔH = -3 × 185 = -555 kJ
2AlCl3(aq)