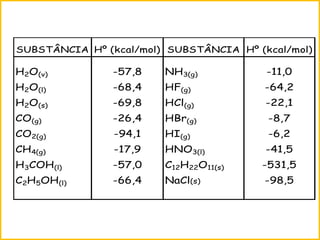
O documento discute termos e conceitos fundamentais da termoquímica, incluindo:
1) A termoquímica estuda a química envolvendo calor absorvido ou liberado em transformações da matéria.
2) A entalpia é a energia acumulada por uma substância sob pressão constante e pode ser calculada usando as entalpias de formação.
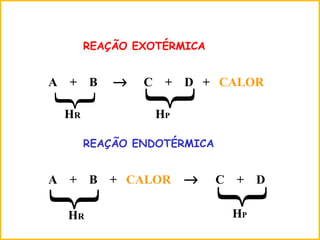
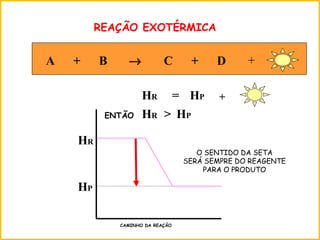
3) Reações químicas podem ser exotérmicas ou endotérmicas dependendo se liberam ou absorvem calor.






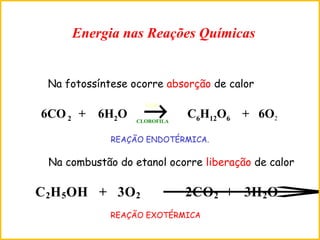







![01) Sendo o ∆H de formação do óxido de ferro (II) igual a – 64,04 kcal/mol e o ∆H
de formação do óxido de ferro (III) igual a – 196,5 kcal/mol, o ∆H da reação
abaixo será:
2 FeO + 1/2 O2 Fe2O3
a) – 68,4 kcal/mol.
b) + 68,4 kcal/mol.
c) – 132,5 kcal/mol.
d) + 132,5 kcal/mol.
e) – 260,5 kcal/mol ΔH = H final – H inicial
ΔH = [ 1 x (– 196,5) ] – [2 x (– 64,04)]
ΔH = (– 196,5) – (– 128,04)
ΔH = – 196,5 + 128,04
ΔH = – 68,42 kcal](https://image.slidesharecdn.com/aula9termoquimica-150728212336-lva1-app6892/85/Termoquimica-19-320.jpg)









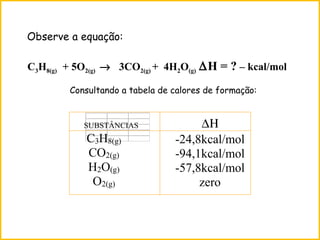
![∆H = ∑∆H(produtos) – ∑∆H(reagentes)
∆H = [ 3(-94,1) + 4(-57,8)] - (-24,8 + zero)
∆H = [3∆HCO2(g)+ 4∆HH2O(g) ] - (∆HC3H8(g)+5∆HO2(g) )
∆H = - 488,7 kcal/mol](https://image.slidesharecdn.com/aula9termoquimica-150728212336-lva1-app6892/85/Termoquimica-30-320.jpg)