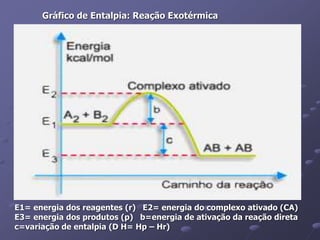
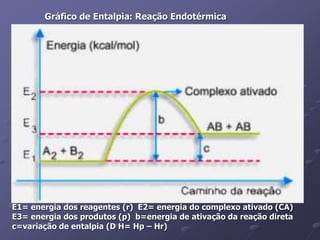
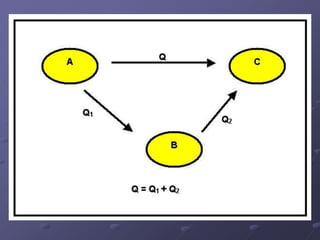
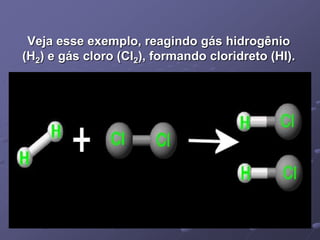
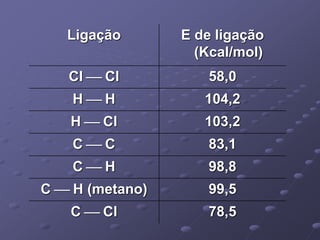
O documento discute termos importantes da termoquímica como entalpia, reações exotérmicas e endotérmicas, calor de formação, combustão e ligação. A lei de Hess permite calcular a variação de entalpia de uma reação através da soma das entalpias de reações intermediárias.