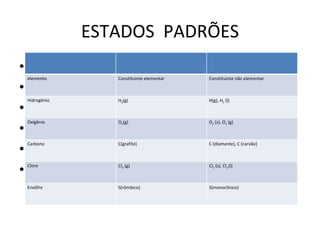
O documento define termos relacionados a estados físicos e reações químicas. Define estado padrão como 25°C e 1 atm, e que apenas substâncias simples nesse estado tem entalpia igual a zero. Explica que calor de formação é a variação de entalpia na formação de um mol da substância a partir de seus constituintes elementares, e que calor de combustão é na combustão completa de 1 mol da substância.