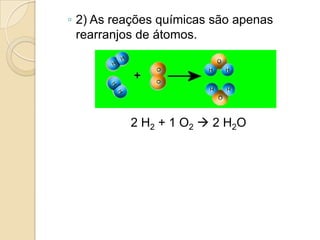
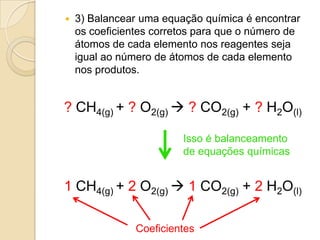
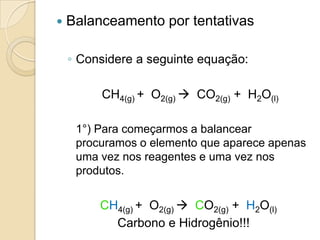
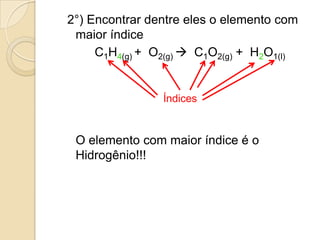
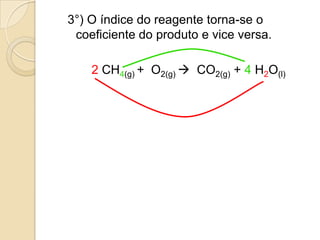
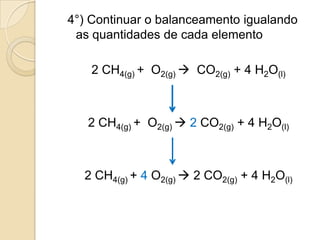
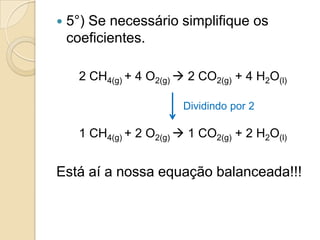
O documento apresenta um resumo sobre balanceamento de equações químicas. Explica que balancear uma equação é igualar o número de átomos de cada elemento nos reagentes e produtos. Fornece como exemplo a equação de formação da água e passos para balancear equações por tentativas, igualando índices dos elementos. Por fim, solicita ao aluno resolver exercícios de balanceamento.