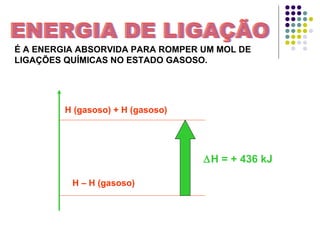
1) A entalpia (H) é a energia total de um sistema medida à pressão constante e não pode ser medida diretamente, apenas a variação de entalpia (ΔH).
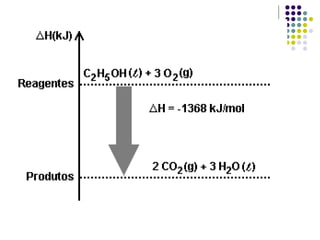
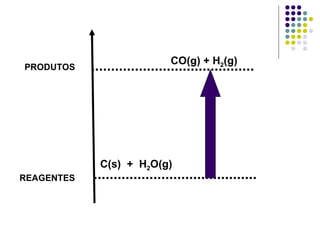
2) Reações exotérmicas liberam calor (ΔH < 0) e endotérmicas absorvem calor (ΔH > 0).
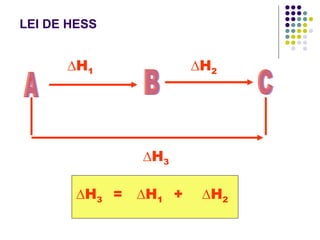
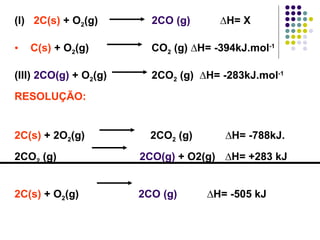
3) A lei de Hess estabelece que a entalpia de uma reação que ocorre em etapas é igual à soma das entalpias de cada etapa.