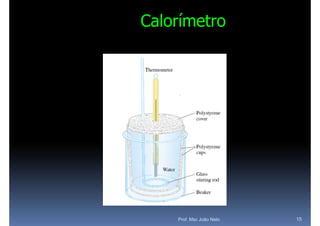
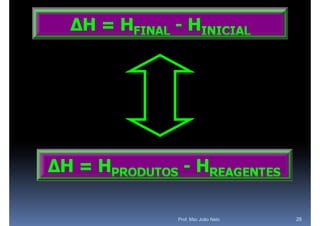
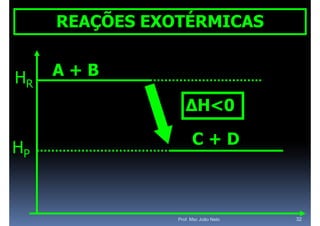
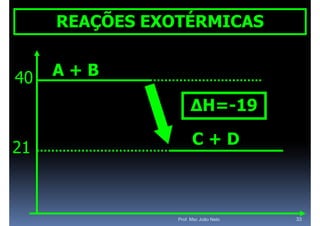
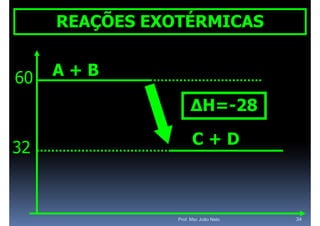
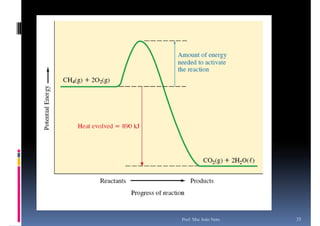
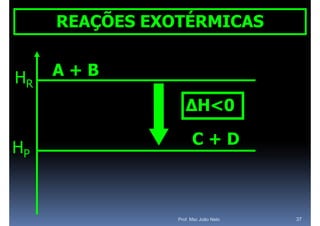
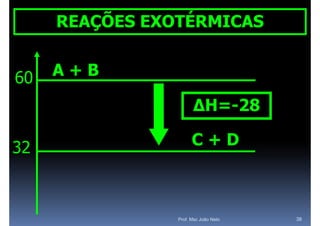
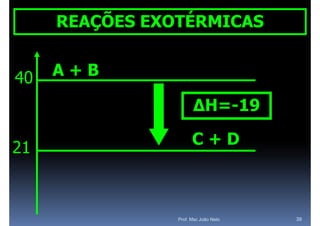
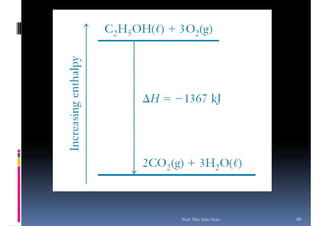
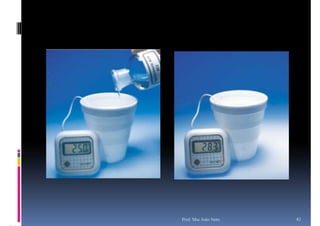
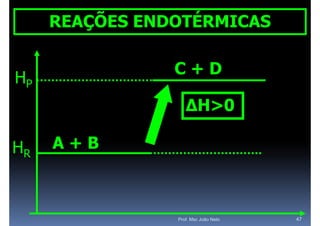
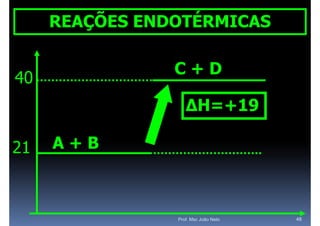
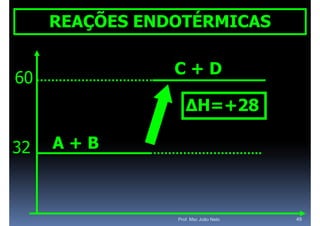
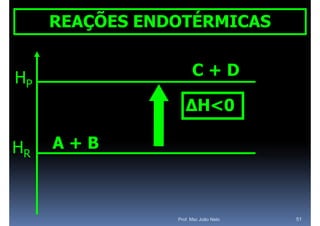
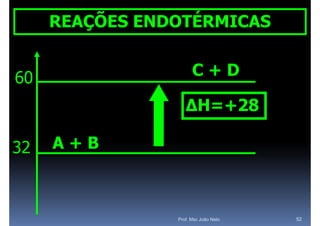
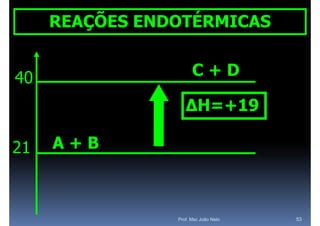
O documento discute termoquímica, que estuda a energia associada a reações químicas. Apresenta exemplos de reações exotérmicas, que liberam energia sob a forma de calor, e reações endotérmicas, que absorvem energia. Explica como calcular a variação de entalpia para determinar a quantidade de calor envolvida em cada processo.