Este documento discute o conceito de equilíbrio químico, incluindo: 1) Como expressar equilíbrio químico de forma quantitativa usando a constante de equilíbrio; 2) A interpretação dos valores da constante de equilíbrio; 3) O cálculo da constante de equilíbrio gasoso Kp.



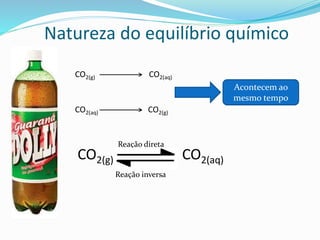




![Relembrando a lei da velocidade
A Lei da Velocidade ou Lei de Guldberg-Waage (1867)
Cato Maximilian Guldberg
(1836-1902)
Peter Waage
(1833-1900)
“A velocidade de uma reação é
diretamente proporcional ao
produto das concentrações
molares dos reagentes, para cada
temperatura, elevada a expoentes
experimentalmente determinados.”
aA + bB cC + dD
V = k[A]a.[B]b
Válida para reações que se
processam em apenas uma etapa](https://image.slidesharecdn.com/equilbrioqumico-151214010826/85/Equilibrio-quimico-12-320.jpg)
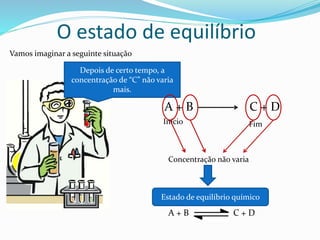
![O estado de equilíbrio
No equilíbrio químico dois processos ocorrem
aA + bB cC + dD
cC + dD aA + bB
aA + bB cC + dD
VD = kD[A]a.[B]b
VI = KI[C]c.[D]d
No eq. Químico: VI = VD
Keq = Equação do equilíbrioConstante de equilíbrio](https://image.slidesharecdn.com/equilbrioqumico-151214010826/85/Equilibrio-quimico-13-320.jpg)


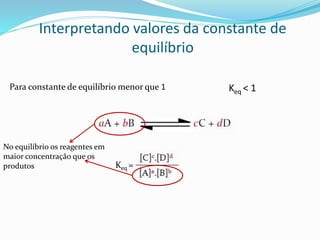

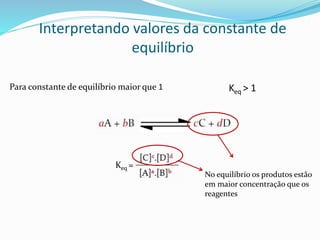

![Atenção aos termos!!!
Keq =
As concentrações na equação estão
relacionadas à uma concentração PADRÃO
A, por exemplo, seria plotado da seguinte maneira
[A] = [A]medido
[A]Padrão [A]°](https://image.slidesharecdn.com/equilbrioqumico-151214010826/85/Equilibrio-quimico-20-320.jpg)
![Concentração padrão
Se o composto em questão estiver dissolvido em água ou um gás
[A]° = 1 mol/l
Se o composto em questão for um líquido ou sólido
[A]° = Concentração nas CNTP
Concentração de líquidos e sólidos é praticamente INVARIÁVEL
Água, por exemplo, possui concentração de 55,5 mol/l](https://image.slidesharecdn.com/equilbrioqumico-151214010826/85/Equilibrio-quimico-21-320.jpg)
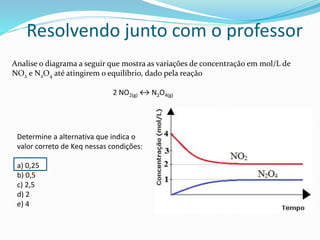
![Resolvendo junto com o professor
Monte a equação de equilíbrio para a reação do zinco metálico em ácido clorídrico
Zn(s) + HCl(aq) ZnCl(aq) + H2(g)
Zinco metálico
Keq = _[ZnCl(aq)]. [H2]__
[HCl(aq)]](https://image.slidesharecdn.com/equilbrioqumico-151214010826/85/Equilibrio-quimico-22-320.jpg)

![Constante de equilíbrio para cálculo mais precisos
Usar atividade dos compostos no lugar da concentração na
equação de equilíbrio químico
aA + bB cC + dD
(aB) = γ.[B]
Atividade de B
Coeficiente de atividade Concentração de B](https://image.slidesharecdn.com/equilbrioqumico-151214010826/85/Equilibrio-quimico-24-320.jpg)




![Resolvendo junto com o professor
Monte a equação de equilíbrio para a reação do zinco metálico em ácido clorídrico
2Na(s) + 2H2O(l) 2NaOH(aq) + H2(g)
Keq = [NaOH(aq)]2. [H2]](https://image.slidesharecdn.com/equilbrioqumico-151214010826/85/Equilibrio-quimico-29-320.jpg)