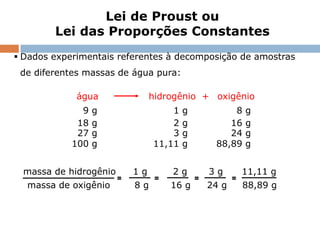
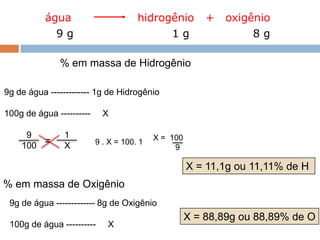
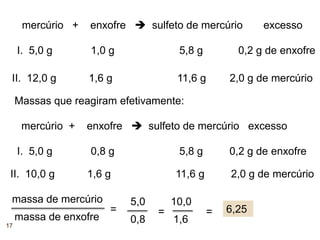
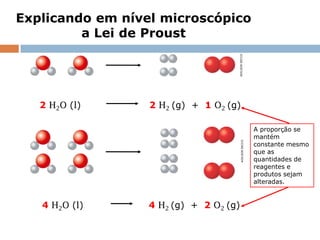
1) O documento descreve a Lei da Conservação da Massa formulada por Antoine Laurênt Lavoisier no século 18.
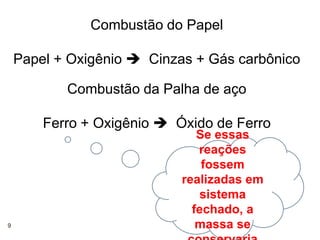
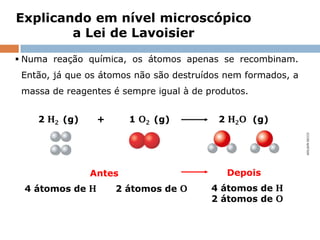
2) A lei estabelece que na reação química a massa total dos reagentes é igual à massa total dos produtos.
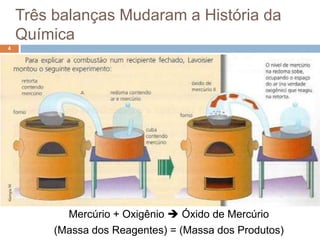
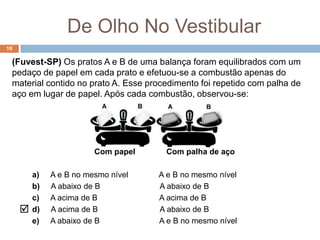
3) Lavoisier realizou experimentos usando balanças para verificar essa lei em sistemas fechados.