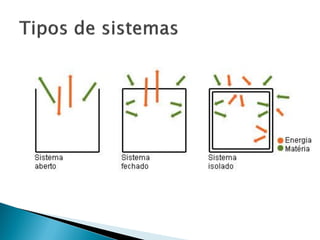
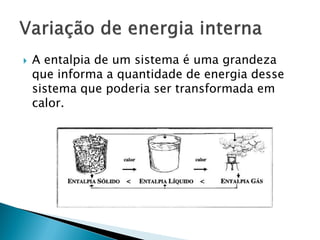
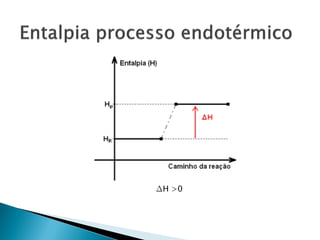
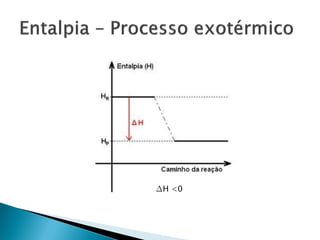
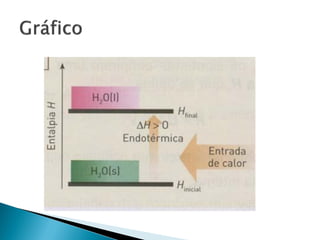
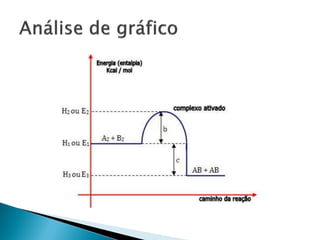
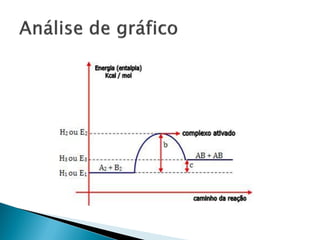
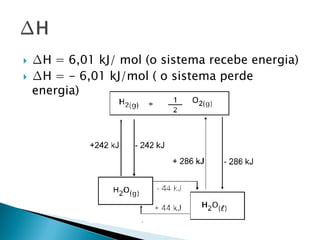
O documento discute conceitos fundamentais de termodinâmica e termoquímica, incluindo: 1) a definição de termodinâmica como o estudo das transformações e transferência de calor, 2) a termoquímica como o estudo termodinâmico de transformações químicas, 3) as grandezas termodinâmicas como energia, calor, temperatura e entalpia.