1) O documento define ácidos como compostos que, em solução aquosa, se ionizam produzindo H+ ou H3O+.
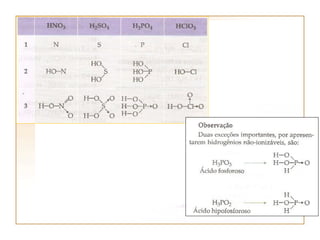
2) Ácidos são classificados de acordo com a presença de carbono ou oxigênio, número de elementos químicos, e grau de ionização.
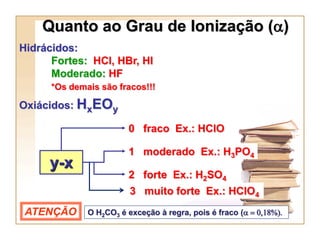
3) Hidrácidos como HCl e HBr são ácidos fortes, enquanto oxiácidos como H2SO4 são mais fortes quanto maior for a diferença entre y-x em sua fórmula HxEOy.



![Classificação dos Ácidos
Quanto ao número de Elementos Químicos:
Binário (HCl, HBr, HF)
Ternário (H2SO4, H3PO4, HCN)
Quaternário (H4[Fe(CN)6])
Quanto ao número de Hidrogênios Ionizáveis:
Monoácidos (HCl, HI, H3PO2)
Diácidos (H2SO4, H2S, H3PO3)
Triácidos (H3PO4, H3BO3)
Tetrácidos (H4P2O7, H4SiO4)](https://image.slidesharecdn.com/cidos-120620155404-phpapp02/85/Acidos-4-320.jpg)