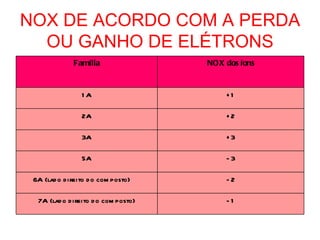
I) O documento explica o que é número de oxidação (NOx) e como ele é determinado de acordo com a perda ou ganho de elétrons por diferentes elementos químicos.
II) São listadas regras práticas para determinar o NOx de diferentes elementos como metais alcalinos, metais alcalinos terrosos, alumínio e hidrogênio.
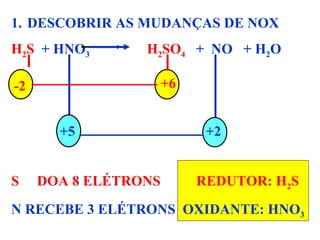
III) O documento também explica o que são agentes oxidantes e redutores e como equilibrar equações redox baseado na igualdade de elétrons doados e recebidos.