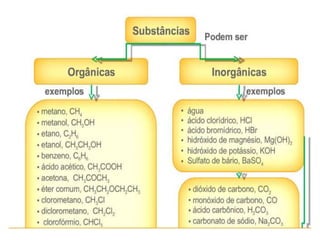
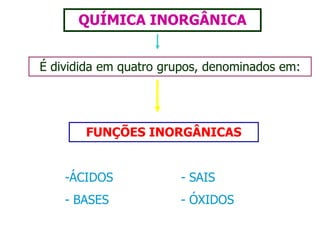
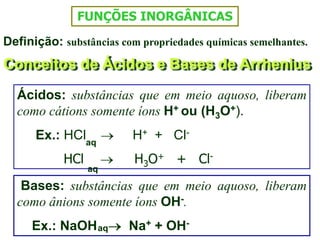
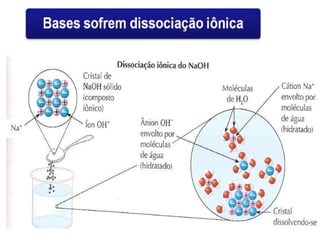
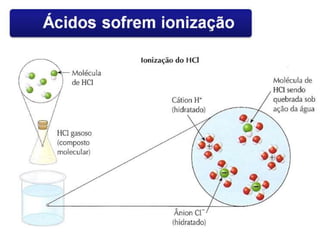
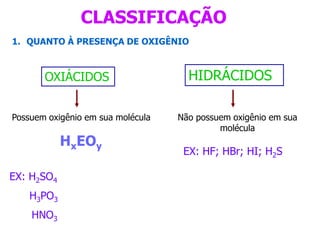
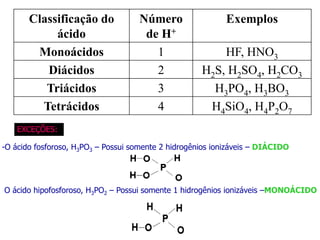
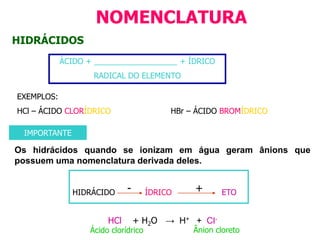
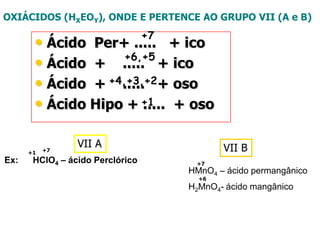
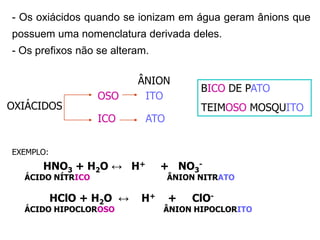
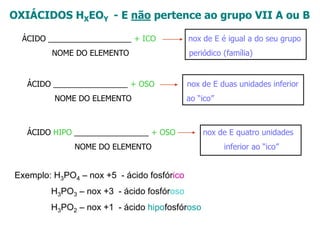
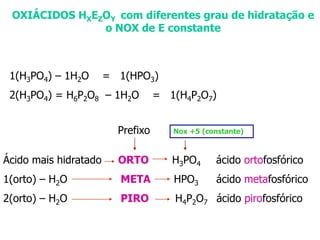
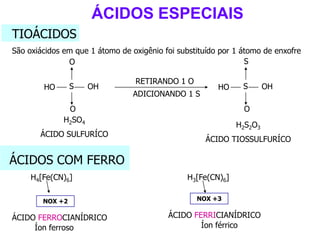
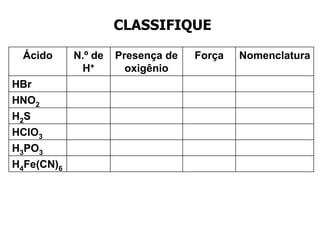
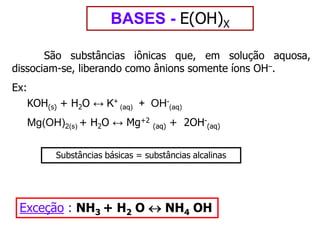
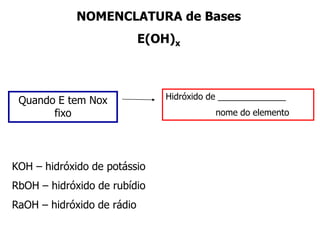
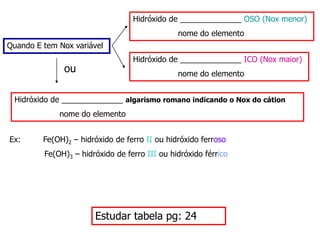
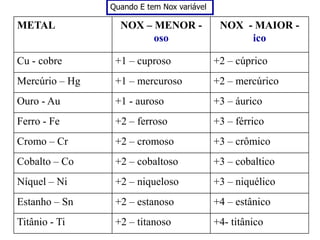
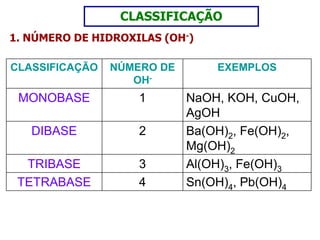
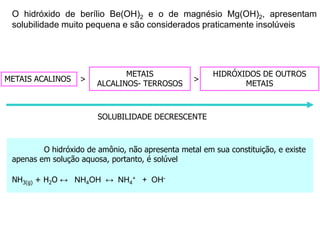
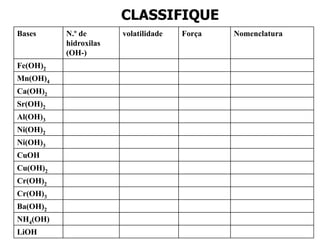
O documento discute os conceitos de química inorgânica, incluindo ácidos, bases e sais. Ácidos são substâncias que liberam íons H+ em solução aquosa, enquanto bases liberam íons OH-. Existem vários tipos de ácidos e bases classificados de acordo com suas propriedades.