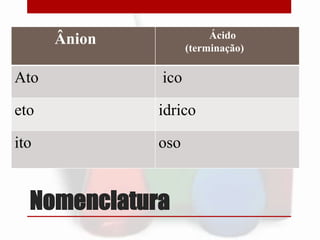
O documento discute as propriedades e classificações dos ácidos. Ácidos são compostos que quando dissolvidos em água liberam íons hidrogênio. Eles podem ser classificados de acordo com o número de hidrogênios ionizáveis, número de elementos na molécula, presença de oxigênio e volatilidade. Alguns dos ácidos mais importantes discutidos incluem ácido clorídrico, sulfúrico, nítrico e acético.