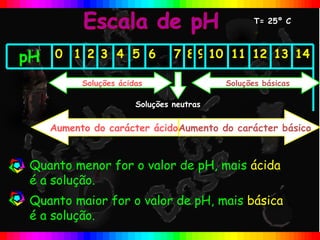
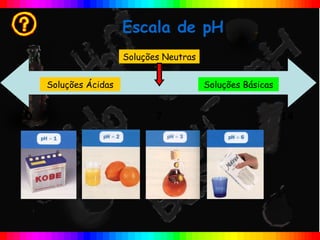
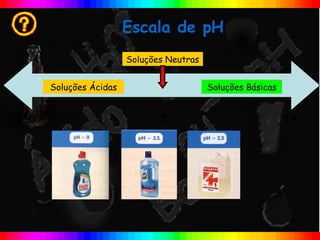
O documento descreve a escala de pH e como ela é usada para medir a acidez ou basicidade de soluções. A escala varia de 0 a 14, com valores abaixo de 7 indicando soluções ácidas e valores acima de 7 indicando soluções básicas. Uma solução com pH=7 é considerada neutra.