1) O documento descreve as principais características de ácidos, bases e sais inorgânicos, incluindo suas definições, classificações, nomenclaturas e exemplos importantes.
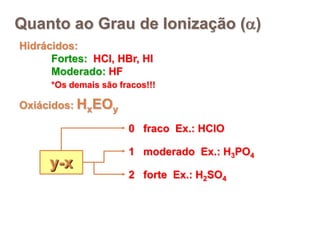
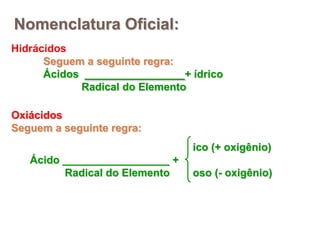
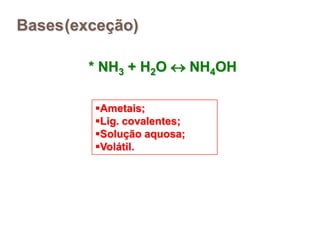
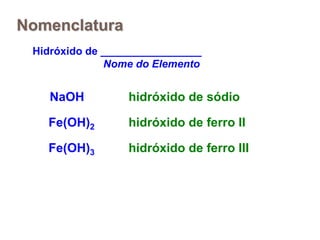
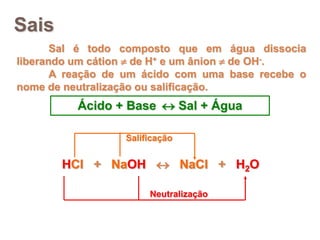
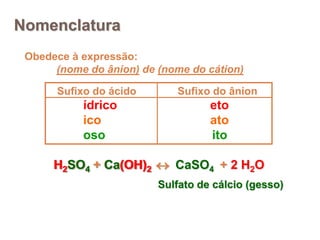
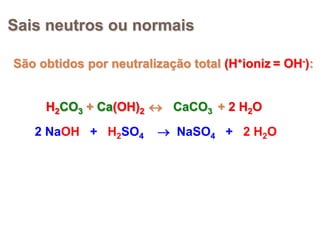
2) Ácidos são substâncias que liberam íons hidrogênio em solução aquosa, enquanto bases liberam íons hidroxila. Sais são formados pela neutralização de ácidos e bases.
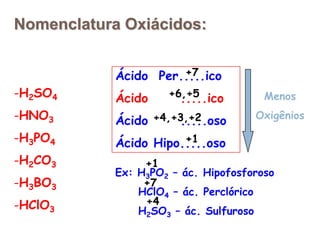
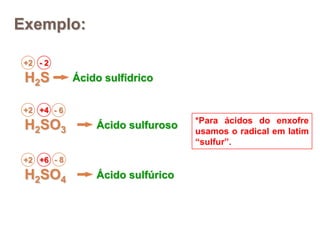
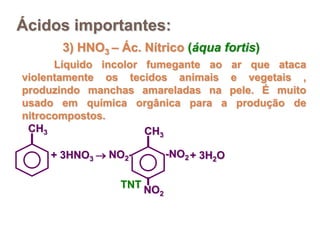
3) Exemplos importantes de ácidos incluem o ácido sulfúrico, clorídrico e nítrico, enquanto exemplos