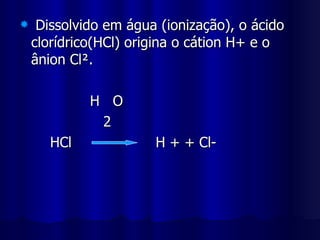
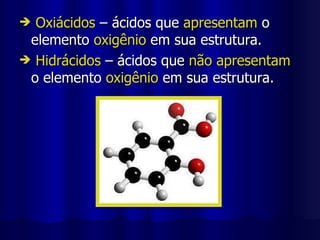
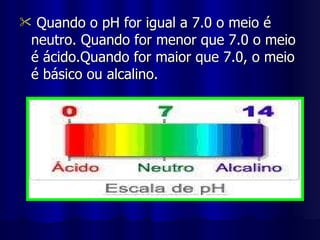
1) Ácidos são compostos que se ionizam em solução aquosa, produzindo íons hidrogênio. 2) Eles contêm hidrogênio combinado com elementos não metálicos ou radicais. 3) Ácidos têm sabor azedo, conduzem eletricidade quando dissolvidos e reagem com bases produzindo água e sal.