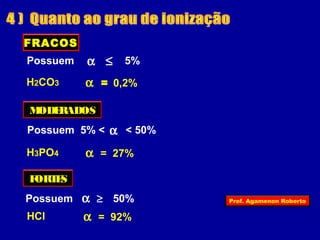
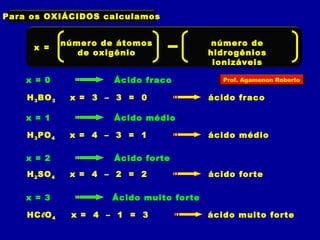
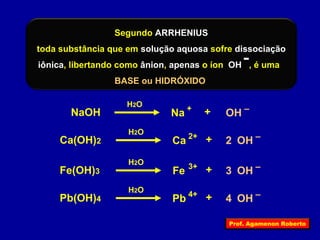
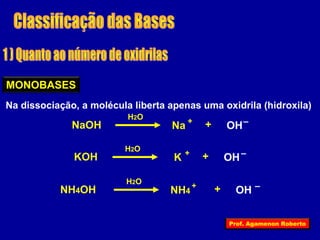
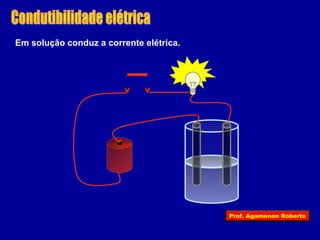
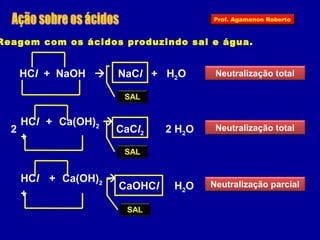
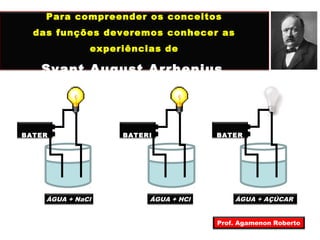
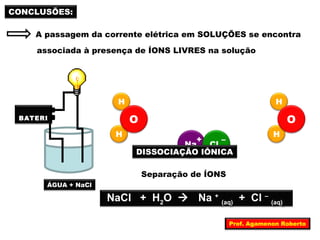
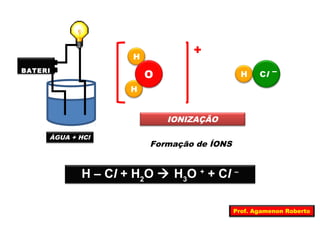
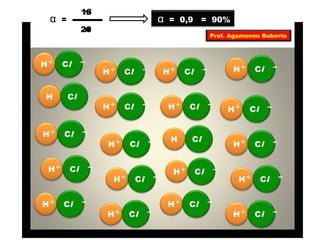
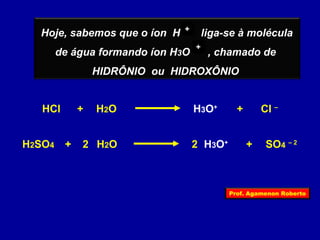
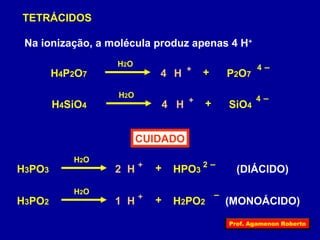
O documento descreve as propriedades funcionais das substâncias químicas e como elas podem ser agrupadas em funções inorgânicas principais como ácidos, bases, sais e óxidos. Também explica os conceitos de ionização e dissociação iônica por meio das experiências de Svante Arrhenius e como isso está relacionado à condução elétrica em soluções.











![HIDRÁCIDOS
São ácidos que não possuem o elemento químico OXIGÊNIO
HCl HCN H2S H4[Fe(CN)6]
OXIÁCIDOS
São ácidos que possuem o elemento químico OXIGÊNIO
HNO3 H2CO3 H2SO4 H3PO4
Prof. Agamenon Roberto](https://image.slidesharecdn.com/funesinorgnicas-140906192449-phpapp02/85/Funcoes-inorganicas-18-320.jpg)
![Possuem apenas dois elementos químicos
HCl
H2S
TERNÁRIOS
H2CO3 HCN H2SO4
H4[Fe(CN)6]
BINÁRIOS
Possuem apenas três elementos químicos
QUATERNÁRIOS
Possuem apenas quatro elementos químicos
Prof. Agamenon Roberto](https://image.slidesharecdn.com/funesinorgnicas-140906192449-phpapp02/85/Funcoes-inorganicas-19-320.jpg)