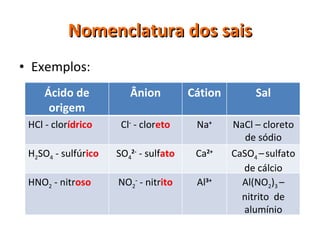
O documento discute as funções químicas inorgânicas, dividindo-as em ácidos, bases e sais. Apresenta as propriedades funcionais e classificações destas substâncias, incluindo o grau de ionização, número de hidrogênios/hidroxilas e presença de oxigênio. Explica também a nomenclatura destas substâncias.