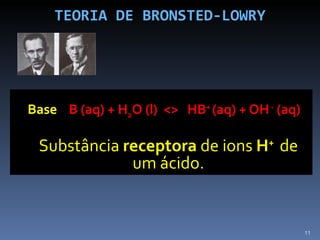
1) O documento discute ácidos, bases e suas teorias, incluindo as teorias de Arrhenius, Bronsted-Lowry e indicadores de pH.
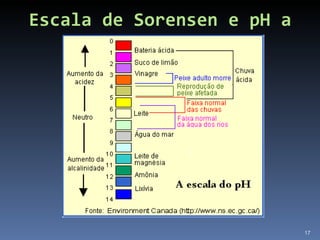
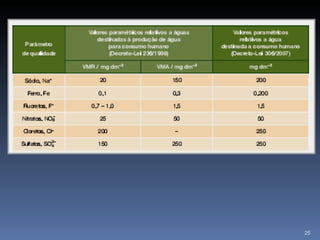
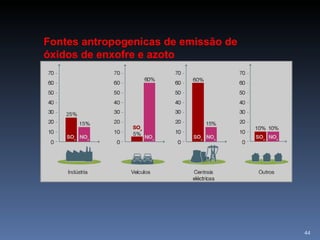
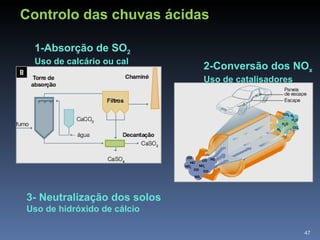
2) Também aborda aplicações como purificação de água, solo para cultivo, chuva ácida e soluções tampão.
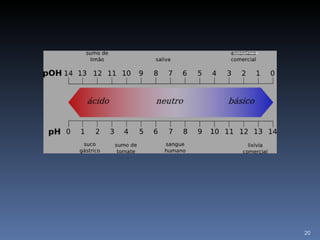
3) Define ácidos e bases segundo diferentes teorias químicas e explica como medir pH.






























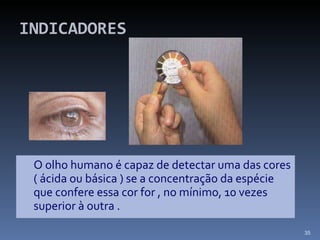



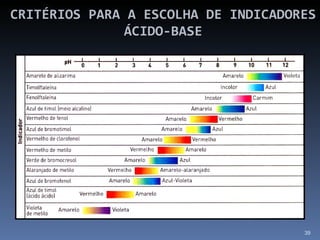
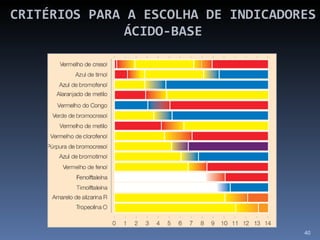

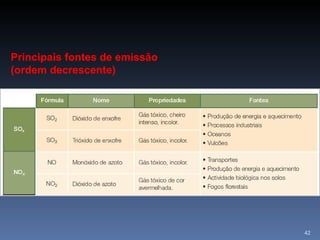




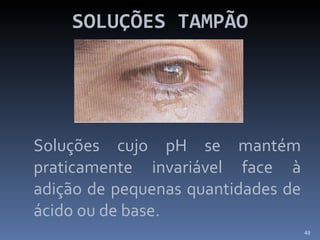

![SOLUÇÕES TAMPÃO Teremos melhor efeito tampão quando: [Ácido ] = [Base]](https://image.slidesharecdn.com/slidescidosebases-111002194731-phpapp02/85/Slides-acidos-e-bases-51-320.jpg)