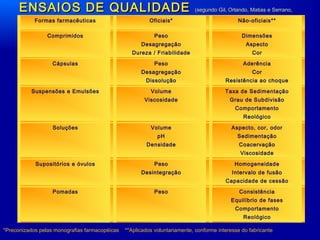
O documento discute o controle de qualidade de medicamentos, incluindo definições de medicamentos, formas farmacêuticas e categorias de registro na ANVISA. Também aborda procedimentos de controle de qualidade como validação de métodos analíticos, ensaios de qualidade e controle microbiológico.