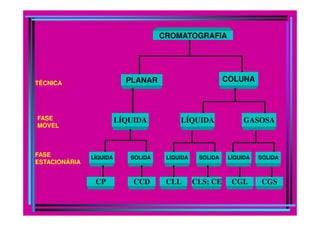
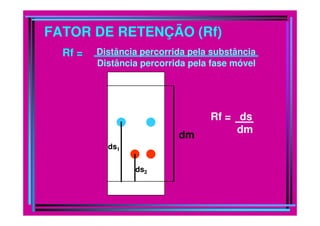
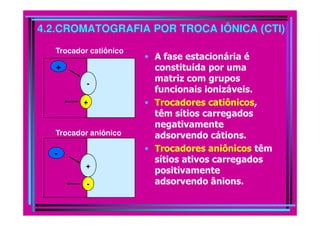
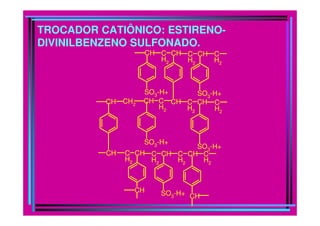
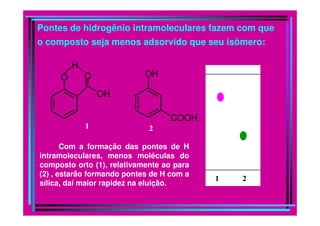
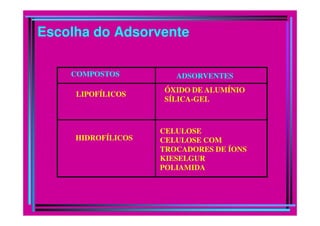
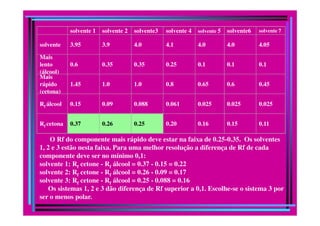
A cromatografia foi desenvolvida em 1903 por Mikhail Tswett para separar pigmentos vegetais. É um método físico-químico de separação baseado na migração diferencial dos componentes de uma mistura devido a diferentes graus de interação entre duas fases imiscíveis, uma móvel e outra fixa. Existem vários tipos de cromatografia classificados pela fase móvel, fase estacionária e modo de separação, como cromatografia líquida, gasosa e por exclusão, adsorção, partição ou troca